题目内容
5.在三氯化铁溶液中加入氢氧化钠溶液,会产生红褐色色沉淀,其反应离子方程式为Fe3++3OH-=Fe(OH)3↓,若要检验溶液中是否含有三价铁离子可加入KSCN溶液.除去氯化亚铁溶液中的三氯化铁,可加入铁粉.分析 三氯化铁溶液中加入氢氧化钠溶液,会发生复分解反应,铁离子的检验用硫氰化钾,金属铁可以和氯化铁反应生成氯化亚铁,据此回答.
解答 解:三氯化铁溶液中加入氢氧化钠溶液,会发生复分解反应,生成氢氧化铁红褐色沉淀,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,若要检验溶液中是否含有三价铁离子可加入硫氰化钾,看是否出现红色,金属铁可以和氯化铁之间反应生成氯化亚铁,除去氯化亚铁溶液中的三氯化铁,可加入金属铁,
故答案为:红褐色;Fe3++3OH-=Fe(OH)3↓;KSCN;铁粉.
点评 本题考查学生铁以及化合物的性质以及铁离子的检验和物质的除杂知识,属于基本知识的考查,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
15.16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 16O与18O互为同素异形体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 标准状况下,11.2L16O2和11.2L18O2均含NA个氧原子 |
13.已知:
分析上表中四种物质的相关数据,请回答:
(1)CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3.
(2)CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是元素的非金属性越强,其氢化物的稳定性越强,分解温度越高.
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时HCl先液化.
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(1)CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3.
(2)CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是元素的非金属性越强,其氢化物的稳定性越强,分解温度越高.
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时HCl先液化.
20.下列表示物质结构的化学用语或模型正确的是( )
| A. | 8个中子的碳原子的核素符号:12C | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | Cl-离子的结构示意图: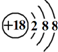 | D. | CH4分子的球棍模型: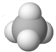 |
10.某同学感冒发烧,他可服用下列哪种药品进行治疗( )
| A. | 麻黄碱 | B. | 阿司匹林 | C. | 抗酸药 |
17.NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 L 2 mol•L-1的醋酸钠溶液中CH3COO- 的数目小于2NA | |
| B. | 常温常压下,1.12 L O2气体所含原子数为0.1NA | |
| C. | 将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA | |
| D. | 1 mol羟基含有的电子数为10NA |
14.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 周期表中位置靠近的元素性质相似 |
 A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.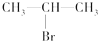 (主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.
(主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.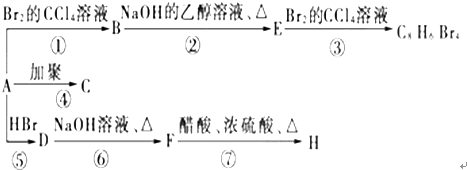
 ②的反应类型:消去反应
②的反应类型:消去反应 +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$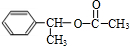 +H2O,反应类型:酯化(取代)反应
+H2O,反应类型:酯化(取代)反应