题目内容
17.NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1 L 2 mol•L-1的醋酸钠溶液中CH3COO- 的数目小于2NA | |
| B. | 常温常压下,1.12 L O2气体所含原子数为0.1NA | |
| C. | 将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA | |
| D. | 1 mol羟基含有的电子数为10NA |
分析 A、CH3COO-是弱酸根,在溶液中会水解;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、2mol一氧化氮与1mol氧气反应生成2mol二氧化氮,由于二氧化氮与四氧化二氮存在转化平衡,导致反应后的气体分子小于2mol;
D、羟基的化学式为-OH,不显电性.
解答 解:A、CH3COO-是弱酸根,在溶液中会水解,故溶液中CH3COO-的个数小于2NA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故1.12L氧气的物质的量小于0.05mol,故所含的氧原子的个数小于0.1NA个,故B错误;
C、由于二氧化氮与四氧化二氮之间存在转化平衡,所以反应后生成的气体的总物质的量小于2mol,分子总数小于2NA,故C错误;
D、羟基的化学式为-OH,不显电性,故1mol羟基含9mol电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
7.某元素最高价氧化物对应水化物的化学式是H2XO3,这种元素的气态氢化物的分子式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
8.下列说法中不正确的是( )
| A. | H2O和H2O2两种分子中O原子的杂化类型相同 | |
| B. | NH3和NH4+两种微粒的空间结构相同 | |
| C. | SO42-和ClO4-两种微粒的键角相等 | |
| D. | SO2和O3两种分子是等电子体 |
12.已知NO与H2反应后生成1molN2和水蒸气时,放出665kJ热量,其反应机理为:①2NO=N2O2(快)②N2O2+H2=N2O+H2O(慢)③N2O+H2=N2+H2O(g)(快).下列说法正确的是( )
| A. | 整个过程的反应速率由反应②决定 | B. | N2O2,N2O是该反应的催化剂 | ||
| C. | 当$\frac{1}{2}$v(NO)=v(N2)时,反应达到平衡 | D. | 该反应的活化能为665kJ•mol-3 |
13.下列说法正确的是( )
| A. | 按系统命名法,烷烃 的名称是2,4-二甲基-2-乙基戊烷 的名称是2,4-二甲基-2-乙基戊烷 | |
| B. | 丙烯酸(CH2=CH-COOH)能发生取代加聚缩聚反应 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下都能发生水解反应 | |
| D. | 等物质的量的HCOOCH3和CH3CHO完全燃烧,产物均通过足量的过氧化钠并充分反应,固体增重相同 |
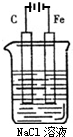 如图是电解NaCl溶液的示意图.请回答下列问题:
如图是电解NaCl溶液的示意图.请回答下列问题: