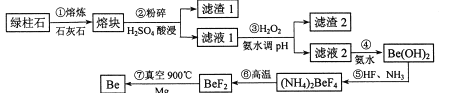
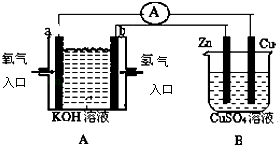
题目内容
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是
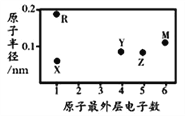
A. 简单阳离子半径:X
B. M的氢化物常温常压下为气体,分子间无氢键
C. 最高价氧化物的水化物的酸性:Z<Y
D. X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
【答案】C
【解析】X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为IA族元素,Y最外层有4个电子,位于IVA族,Z原子最外层有5个电子位于VA族,M子最外层有6电子位于VIA族;R的原子半径最大,是Na元素;X的原子半径最小是H元素;Y和Z的原子半径接近,M原子半径大于Y而最外层电子数大于Y,所以Y是C,Z是N,M是S元素。A、离子半径H++,电子层数越多,离子半径越大,故A正确;B、S的氢化物为H2S,常温常压下为气体,分子间无氢键,故B正确;C、元素的非金属性越强,其最高价含氧酸酸性越强,非金属性N>C,所以最高价含氧酸酸性HNO3>H2CO3,故C错误;C和H可以形成C6H6、C2H4均为平面结构,分子中存在极性共价键和非极性共价键,故D正确;故选C。

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目