题目内容
【题目】1,3﹣丁二烯和2﹣丁炔分别与氢气反应的热化学方程式如下:CH2=CH﹣CH=CH2 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-236.6kJ/mol CH3﹣C≡C﹣CH3 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-272.7kJ/mol。由此不能判断 ( )
A. 1,3﹣丁二烯和2﹣丁炔稳定性的相对大小
B. 1,3﹣丁二烯和2﹣丁炔分子储存能量的相对高低
C. 1,3﹣丁二烯和2﹣丁炔相互转化的热效应
D. 一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
【答案】D
【解析】
①CH2=CH﹣CH=CH2 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-236.6kJ/mol
②CH3﹣C≡C﹣CH3 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-272.7kJ/mol
根据盖斯定律,②-①得到CH3﹣C≡C﹣CH3 (g)→CH2=CH﹣CH=CH2 (g) H=-36.1kJ/mol 。
A项,2-丁炔转化为1,3-丁二烯需要放热,物质所具有能量越低越稳定,可判断1,3-丁二烯更稳定,故不选A项;
B项,2-丁炔转化为1,3-丁二烯需要放热,能判断1,3-丁二烯和2-丁炔分子储存能量的相对高低,故不选B项;
C项,由分析知可计算出二者转化的热效应,故不选C项;
D项,1个1,3-丁二烯分子中含有2个C=C键,6个C-H键和1个C-C键,1个2-丁炔分子中含有1个C![]() C键,6个C-H键和2个C-C键,两者碳碳单键数目不同,故不能判断出两个碳碳双键的键能之和与一个碳碳叁键的键能的大小,故选D项。
C键,6个C-H键和2个C-C键,两者碳碳单键数目不同,故不能判断出两个碳碳双键的键能之和与一个碳碳叁键的键能的大小,故选D项。
综上所述,本题正确答案为D。

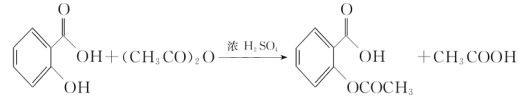
【题目】阿司匹林(乙酰水杨酸,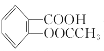 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
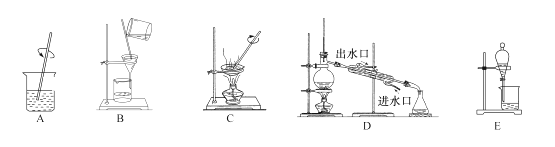
制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是_____.
(2)合成阿司匹林时,最合适的加热方法是_____.
(3)提纯粗产品流程如下,加热回流装置如图:
![]()
①使用温度计的目的是控制加热的温度,防止_____.
②冷凝水的流进方向是_____(填“a”或“b”);
③趁热过滤的原因是_____.
④下列说法正确的是_____(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸

(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为_____(用百分数表示,小数点后一位).