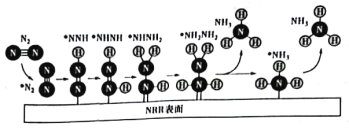
题目内容
【题目】(1)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,写出反应方程式______________________。
(2)工业上制取漂白粉的的过程是把氯气通入石灰乳中,写出反应方程__________________。
(3)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时甲为负极;把乙、丁分别浸入相同浓度的稀硫酸中,乙产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是__________________。
(4)将气体A、B置于容积为2 L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,则:vA=_________,反应前A有_________mol。
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:______; __________。
(6)碳是周期表中形成化合物最多的元素,写出其单质与浓硫酸反应的方程式___________________写出能验证碳的非金属性弱于硫的化学反应的离子方程式:_____________________,碳还能形成各种有机物,它的一种有机物可由粮食发酵得到,有特殊的香味,有活血壮胆的功效,写出该有机物在某条件下与氧气催化氧化的反应方程式_______________。
【答案】2FeCl3+Cu=2FeCl2+CuCl2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 乙>甲>丙>丁 0.05 mol/(L·s) 0.9 Al(OH)3+OH-= AlO2-+2H2O Al(OH)3+3H+=Al3++3H2O C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O 2H++CO32-=CO2↑+ H2O 2CH3CH2OH+O2
CO2↑+2SO2↑+2H2O 2H++CO32-=CO2↑+ H2O 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
(1)FeCl3与Cu反应产生FeCl2、CuCl2;
(2)Cl2与石灰乳反应产生氯化钙、次氯酸钙和水,氯化钙、次氯酸钙的混合物为漂白粉;
(3)两种不同的金属形成原电池时,活动性强的为负极,活动性弱的为正极;活动性不同的金属与酸反应置换出氢气,金属元素越活泼,反应产生氢气速率越快;活动性强的金属可以把活动性弱的金属置换出来,据此比较元素金属性强弱;
(4)根据v=![]() 计算v(C),再利用速率之比等于化学计量数之比计算v(A),再计算出A反应的物质的量,然后根据A起始物质的量等于剩余量与消耗量的和计算反应开始时A的物质的量;
计算v(C),再利用速率之比等于化学计量数之比计算v(A),再计算出A反应的物质的量,然后根据A起始物质的量等于剩余量与消耗量的和计算反应开始时A的物质的量;
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,则该元素是Al,其最高价氧化物的水化物是两性氢氧化物,其余元素中金属元素形成的最高价氧化物的水化物是碱;非常金属元素形成的最高价氧化物的水化物是含氧酸,然后根据Al(OH)3与酸、碱反应的性质书写反应的离子方程式;
(6)C与浓硫酸共热反应产生CO2、SO2、H2O,可通过强酸与弱酸的盐发生反应制取弱酸,来比较元素非金属性的强弱;C元素的一种有机物可由粮食发酵得到,有特殊的香味,有活血壮胆的功效,该物质是乙醇,乙醇催化氧化产生乙醛,据此书写反应方程式。
(1)FeCl3具有强的氧化性,能够与线路板中的Cu发生氧化还原反应产生FeCl2、CuCl2,根据电子守恒、原子守恒,可得该反应的化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2;
(2)Cl2与石灰乳反应产生CaCl2、Ca(ClO)2、H2O,该反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)把甲、丙浸入稀硫酸中,用导线连接时甲为负极,则金属活动性:甲>丙;把乙、丁分别浸入相同浓度的稀硫酸中,乙产生气泡的速率更大,说明金属乙比金属丁活泼,即金属活动性:乙>丁;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出,说明甲为正极,乙为负极,所以金属活动性:乙>甲;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出,说明丙比丁活泼,即金属活动性:丙>丁。故这四种金属的活动性由强到弱的顺序是:乙>甲>丙>丁;
(4)4 s末,测得C为0.2 mol,则v(C)=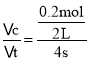 =0.025 mol/(L·s),由于用不同物质表示的化学反应速率之比等于化学计量数之比,则v(A)=2v(C)=0.025 mol/(L·s)×2=0.05 mol/(L·s),4 s内A改变的物质的量为△n(A)=0.05 mol/(L·s)×4 s×2 L=0.4 mol,此时剩余A物质0.5 mol,故反应开始时A的物质的量n(A)=0.5 mol+0.4 mol=0.9 mol;
=0.025 mol/(L·s),由于用不同物质表示的化学反应速率之比等于化学计量数之比,则v(A)=2v(C)=0.025 mol/(L·s)×2=0.05 mol/(L·s),4 s内A改变的物质的量为△n(A)=0.05 mol/(L·s)×4 s×2 L=0.4 mol,此时剩余A物质0.5 mol,故反应开始时A的物质的量n(A)=0.5 mol+0.4 mol=0.9 mol;
(5)Al(OH)3是两性氢氧化物,既能与强酸反应产生盐和水,也能够与强碱反应产生盐和水,NaOH与Al(OH)3反应产生NaAlO2和H2O,反应的离子方程式为:Al(OH)3+OH-= AlO2-+2H2O;Al(OH)3与硫酸反应产生Al2(SO4)3和H2O,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O;
(6)C与浓硫酸共热反应产生CO2、SO2、H2O,该反应的化学方程式为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O;硫酸与Na2CO3发生复分解反应产生Na2SO4、CO2、H2O,该反应的离子方程式为:2H++CO32-=CO2↑+ H2O;可知酸性:H2SO4>H2CO3,从而证明元素的非金属性:S>C;碳元素的一种有机物可由粮食发酵得到,有特殊的香味,该物质是乙醇,乙醇在Cu作催化剂条件下加热,被氧气氧化产生乙醛,该反应的化学方程式为:2CH3CH2OH+O2
CO2↑+2SO2↑+2H2O;硫酸与Na2CO3发生复分解反应产生Na2SO4、CO2、H2O,该反应的离子方程式为:2H++CO32-=CO2↑+ H2O;可知酸性:H2SO4>H2CO3,从而证明元素的非金属性:S>C;碳元素的一种有机物可由粮食发酵得到,有特殊的香味,该物质是乙醇,乙醇在Cu作催化剂条件下加热,被氧气氧化产生乙醛,该反应的化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案