题目内容
【题目】氯气是一种重要的化学物质,在生产和生活中有广泛的用途。
(1)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用氯酸钾和浓盐酸反应制备氯气的化学方程式可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中该反应的氧化剂为_____________(填化学式,下同),还原剂为_________________,若反应产生0.3mol Cl2,则消耗的还原剂的物质的量为________mol,反应转移的电子数是_______________。
(2)已知:在加热条件下,3NaClO![]() 2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
【答案】KClO3 HCl 0.5 3.01×1023个(0.5 NA个) 3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O 5:9
NaClO3 +5NaCl+3H2O 5:9
【解析】
(1)根据反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O可以看出,该氧化还原反应中,若有3 mol氯气生成,则有1 mol KClO3中Cl元素化合价降低为0价,作氧化剂;6 mol HCl中有5 mol氯元素化合价升高为0价,1 mol HCl起酸性作用生成KCl,即作还原剂的浓盐酸为5 mol,再结合氯气和转移电子之间的关系式、原子守恒计算还原剂的物质的量与实际转移电子数;
(2)加热下,氯气和浓氢氧化钠溶液反应生成氯化钠、氯酸钠和水;Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成NaCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比。
根据反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O可以看出,该氧化还原反应中,若有3 mol Cl2生成,则有1 mol KClO3中Cl元素化合价降低为0价,6 mol HCl中有5 mol氯元素化合价升高为0价,1 mol HCl起酸性作用生成KCl,即作还原剂的浓盐酸为5 mol。化合价降低值=化合价升高值=转移电子数=5 mol。则产生0.3 mol Cl2,则消耗的还原剂的物质的量是0.5 mol,转移电子的物质的量也为0.5 mol,所以转移电子数为0.5 mol![]() 6.02
6.02![]() 1023mol-1 = 3.01×1023个(0.5 NA),
1023mol-1 = 3.01×1023个(0.5 NA),
故答案为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;0.5 mol;3.01×1023个(0.5 NA个);
(2)常温下,Cl2可与NaOH溶液反应生成NaCl、NaClO和水,其化学方程式为:Cl2+NaOH=NaCl+NaClO+H2O,根据题意可知,在加热条件下,3NaClO![]() 2NaCl+NaClO3,结合上述两式可得,则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为3Cl2+6NaOH
2NaCl+NaClO3,结合上述两式可得,则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O;
NaClO3 +5NaCl+3H2O;
Cl2生成ClO与ClO3是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO与ClO3的物质的量浓度之比为4:1,则可设ClO为4 mol,ClO3为1 mol,被氧化的Cl共为5 mol,失去电子的总物质的量为4mol×(10)+1mol×(50) = 9mol,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,Cl2生成NaCl是被还原的过程,化合价由0价降低为1价,则得到电子的物质的量也应为9 mol,则被还原的Cl的物质的量为9 mol,所以被氧化的氯元素的物质的量和被还原的氯元素之比为5 mol:9 mol =5:9,
故答案为:3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O;5:9。
NaClO3 +5NaCl+3H2O;5:9。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下列实验装置不能达到实验目的的是
A | B | C | D |
|
|
|
|
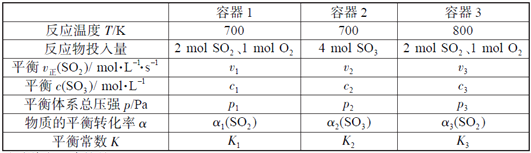
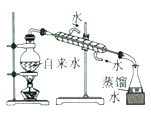
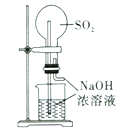
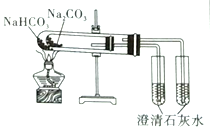
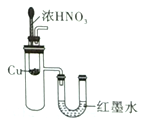
实验室制取蒸馏水 | 用SO2和NaOH溶液做喷泉实验 | 证明Na2CO3的热稳定性比NaHCO3好 | 证明铜与浓硝酸的反应是放热反应 |
A. A B. B C. C D. D
【题目】在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O,摩尔质量为183g/mol),受热过程中不同温度范国内分别得到一种固体物质,其质量如下表:
温度范围℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,210℃~290℃过程中产生的气体只有CO2,则290℃~320℃温度范围内的固体物质是
A. CoO B. Co2O3 C. Co3O4 D. Co4O5