题目内容
10.下列各项叙述中,正确的是( )| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| D. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
分析 A.同主族元素,从上到下电负性减弱;
B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,最后填充p电子;
C.离原子核越远,能量越高;
D.基态Mg的电子排布式为1s22s22p63s2,由基态转化成激发态,电子能量增大,需要吸收能量.
解答 解:A.同主族元素从上到下,电负性减小,则N、P、As的电负性随原子序数的增大而减小,故A错误;
B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,位于第四周期第ⅤA族,最后填充p电子,是p区元素,故B正确;
C.p轨道均为纺锤形,离原子核越远,能量越高,2p轨道能量低于3p,故C错误;
D.基态Mg的电子排布式为1s22s22p63s2,由基态转化成激发态,电子能量增大,需要吸收能量,故D错误,
故选B.
点评 本题考查原子核外电子的排布、电负性,把握电子排布规律及电子排布与元素位置的关系即可解答,注意规律性知识的总结和应用,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
15.下列有关活化分子的说法中正确的是( )
| A. | 活化分子具有的能量比普通分子的能量高 | |
| B. | 发生有效碰撞的分子必为活化分子 | |
| C. | 活化分子之间的碰撞一定都是有效碰撞 | |
| D. | 活化分子数目越多,反应速率一定会变快 |
5.下列物质不能和溴水发生化学反应而能使酸性高锰酸钾退褪色是( )
| A. | C2H5OH | B. | 苯酚 | C. | 甲苯 | D. | 乙醛 |
15.在1 000K时,已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应( )
| A. | 已达平衡状态 | B. | 未达平衡状态,反应正向进行 | ||
| C. | 未达平衡状态,反应逆向进行 | D. | 无法确定 |
2.一定温度下,对于已达到平衡的可逆反应:FeCl3+3KSCN?3KCl+Fe(SCN)3,在此溶液中作如下处理,化学平衡逆向移动的是( )
| A. | 加入少量的KCl固体 | B. | 加入少量FeCl3固体 | ||
| C. | 降低Fe(SCN)3的浓度 | D. | 加水稀释 |
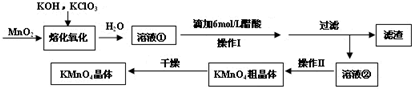
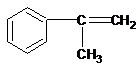 .
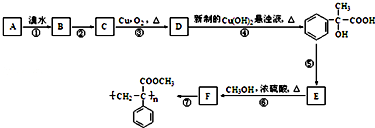
. .
. .
.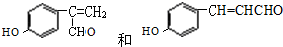 .
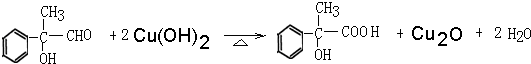
. ,氧化剂是HgS、O2,还原产物:Hg、SO2.
,氧化剂是HgS、O2,还原产物:Hg、SO2.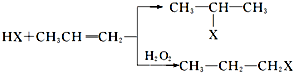 工业上按下列路线合成结构见识为:
工业上按下列路线合成结构见识为: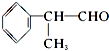 的物质,该物质的一种香料.
的物质,该物质的一种香料.
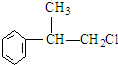 ;A2
;A2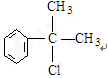 .
.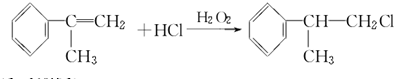 .
.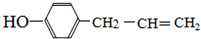 、,
、,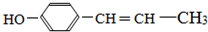 .
.