题目内容
19.用双线桥表示下列反应中电子转移的方向和数目,指出氧化剂和还原产物.HgS+O2═Hg+SO2.
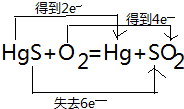 ,氧化剂是HgS、O2,还原产物:Hg、SO2.
,氧化剂是HgS、O2,还原产物:Hg、SO2.
分析 该反应中Hg元素化合价由+2价变为0价、O元素化合价由0价变为-2价、S元素化合价由-2价变为+4价,该反应中得失电子数为6,标出电子转移的方向和数目,由此分析解答.
解答 解:该反应中Hg元素化合价由+2价变为0价、O元素化合价由0价变为-2价、S元素化合价由-2价变为+4价,该反应中得失电子数为6, ,该反应中氧化剂是HgS、O2;还原产物:Hg、SO2,
,该反应中氧化剂是HgS、O2;还原产物:Hg、SO2,
故答案为: ,氧化剂是HgS、O2,还原产物:Hg、SO2.
,氧化剂是HgS、O2,还原产物:Hg、SO2.
点评 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,注意该反应中反应物都是氧化剂,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
4.下列物质在水溶液中能够全部电离的是( )
| A. | H2O | B. | NH3•H2O | C. | CH3COONH4 | D. | CH3COOH |
10.下列各项叙述中,正确的是( )
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| D. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
7. 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025mol/(L•min) | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡移动 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75% |
14.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.请用化学用语回答下列问题:
(1)X元素单质分子结构式N≡N
(2)X、Y、Z三种元素最低价氢化物的沸点最高的是H2O
(3)写出两种由X、Y和氢三种元素形成的不同类别的化合物的化学式:HNO3、NH3•H2O (每个类别任写一种)
(4)Z元素的单质与水反应的化学方程式2F2+2H2O=4HF+O2
(5)W、T的最高价氧化物对应的水化物酸性较弱的是H2GeO3.
| X | Y | Z | |
| W | |||
| T |
(2)X、Y、Z三种元素最低价氢化物的沸点最高的是H2O
(3)写出两种由X、Y和氢三种元素形成的不同类别的化合物的化学式:HNO3、NH3•H2O (每个类别任写一种)
(4)Z元素的单质与水反应的化学方程式2F2+2H2O=4HF+O2
(5)W、T的最高价氧化物对应的水化物酸性较弱的是H2GeO3.
11.在“电解饱和食盐水”的实验探究中,将有关实验现象所得结论填入下表.
电解饱和食盐水的化学方程式为:2NaCl+2H2O电解_2NaOH+Cl2↑+H2↑.
| 实验现象 | 结论 | |
| ① | 通电后,铁棒和石墨棒上都有气泡冒出 | |
| ② | 将阴极上方收集的气体靠近火焰,有爆鸣声 | |
| ③ | 阳极收集到的气体呈黄绿色,可使湿润的淀粉KI试纸变蓝 | |
| ④ | 铁棒一端的溶液滴加酚酞后变红 |
8.下列离子方程式书写正确的是( )
| A. | 碳酸钙跟稀盐酸反应CO32-+2H+=CO2↑+H2O | |
| B. | 向碳酸钠溶液中加入过量醋酸溶液CO32-+2H+=CO2↑+H2O | |
| C. | 氯气与水反应Cl2+H2O=2H++Cl-+ClO- | |
| D. | 三氯化铝溶液与氨水Al3++3NH3•H2O=Al(OH)3↓+3NH4 + |
9.下列关于化学反应的速率和限度的说法错误的是( )
| A. | 化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示 | |
| B. | 影响化学反应速率的条件只有温度和催化剂 | |
| C. | 化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态 | |
| D. | 催化剂只能加快化学反应速率,不能提高原料利用率和转化率 |