题目内容
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
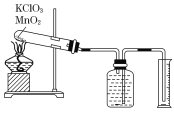
实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置,检查装置的气密性。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL.
⑤准确称量试管和残留物的质量为15.55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________________________________________。
(2)试管中发生的化学反应方程式为:_______________________________________。
(3)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同
②使试管和广口瓶内气体都冷却至室温
③读取量筒内液体的体积
这三步操作的正确顺序是___________(请填写步骤代码)。
进行③的实验操作时,若仰视读数,则读取氧气的体积________(填“偏大”、“偏小”或“无影响”)。
(4)实验过程中产生氧气的物质的量是________mol;实验测得氧气的摩尔体积是________(保留小数点后两位)。
【答案】往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气。2KClO3 ![]() 2KCl+3O2↑②①③偏小0.012522.38 L·mol-1
2KCl+3O2↑②①③偏小0.012522.38 L·mol-1
【解析】
(1)检查装置的气密性的方法:往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气。
(2)试管中的反应物为氯酸钾粉末和少量二氧化锰粉末,加热会发生化学反应生成氧气和氯酸钾。其化学反应方程式为2KClO3 ![]() 2KCl+3O2↑。
2KCl+3O2↑。
(3)测量收集到气体体积必须包括的步骤:②先使试管和广口瓶内气体都冷却至室温,①在调整量筒的高度使广口瓶和量筒内的液面高度相同,③才能读取量筒内液体的体积。三步操作的正确顺序是②①③。读取量筒内液体的体积时,若仰视读数,则读取氧气的体积偏小。答案:②①③ 偏小
(4) 准确称量试管和药品的总质量为15.95 g,准确称量试管和残留物的质量为15.55 g,根据质量守恒定律,产生氧气的质量为m=15.95 g-15.55 g=0.40g,根据n=m/M=0.40g/32g![]() mol-1=0.0125mol;由测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL,根据Vm=V/n=(279.7 mL
mol-1=0.0125mol;由测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL,根据Vm=V/n=(279.7 mL![]() 10-3)/0.0125mol=22.38 L·mol-1.答案:22.38 L·mol-1。
10-3)/0.0125mol=22.38 L·mol-1.答案:22.38 L·mol-1。