题目内容
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
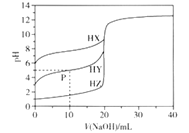
A. 电离常数Ka(HX)的数量级为10-12
B. HX的电离程度大于X-的水解程度
C. pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D. P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
【答案】D
【解析】A.根据图像,0.100 mol/LHX溶液的pH=6,则Ka(HX)=![]() =
=![]() = 10-11,故A错误;B. X-的水解平衡常数Kh=
= 10-11,故A错误;B. X-的水解平衡常数Kh=![]() =
=![]() =10-3>Ka(HX),HX的电离程度小于X-的水解程度,故B错误;C.根据电荷守恒,pH=7时,三种溶液中都存在c(X-) = c1(Na+),c(Y-)= c2(Na+),c(Z-)== c3(Na+),而三种酸的强弱不同,则pH=7时,消耗的氢氧化钠的体积不同,即c1(Na+)≠ c2(Na+)≠ c3(Na+),故C错误;D. P点对应的溶液中存在等浓度的HY和NaY,溶液显酸性,说明以HY的电离为主,则c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-),故D正确;故选D。
=10-3>Ka(HX),HX的电离程度小于X-的水解程度,故B错误;C.根据电荷守恒,pH=7时,三种溶液中都存在c(X-) = c1(Na+),c(Y-)= c2(Na+),c(Z-)== c3(Na+),而三种酸的强弱不同,则pH=7时,消耗的氢氧化钠的体积不同,即c1(Na+)≠ c2(Na+)≠ c3(Na+),故C错误;D. P点对应的溶液中存在等浓度的HY和NaY,溶液显酸性,说明以HY的电离为主,则c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-),故D正确;故选D。

 名校课堂系列答案
名校课堂系列答案【题目】自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。回答下列问题:
(1)已知:①1g H2 完全燃烧生成H2O(g)放出121kJ 的热量;
②N2(g) +O2(g)==2NO(g) △H =+180.5kJ·mol-1
③4NH3(g) +5O2(g)==4NO(g) +6H2O(g) △H =-906.2kJ·mol-1
工业合成氨的热化学方程式是_________________________________________。
(2)应用化石燃料(特别是煤)制备的原料气H2 中含有杂质碳( 主要成分为CO2)、杂质硫主要成分为H2S)。工业上采用湿法脱硫的方法回收硫,方法是先用纯碱溶液吸收H2S,使之转化为NaHS,然后用偏钒酸钠(NaVO3)溶液氧化硫元素,使之转化为硫单质,并生成焦钒酸钠( Na2V4O9),混法脱硫中发生的氧化还原反应的化学方程式是_________________________,反应中转移2×103mol电子时,理论上回收硫_______kg。
(3)工业上利用NH3为原料合成尿素,其原理是2 NH3(g) +CO2(g)![]() CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
合成尿素的反应为_____________(填“放热反应”或“吸热反应”)。
②合成尿素的原料气中NH3和CO2的物质的量之比称为氨碳比,可用[n(NH3)]/[n(CO2)]表示。在一定温度和压强下,图甲中曲线________(填“I”或“II”)表示的是氨碳比与CO2的转化率(a)的关系,判断理由是_______________________________;当[n(NH3)]/[n(CO2)]=4时,NH3的转化率为_______________。

(4)利用特殊的材料,通过电化学法也可以合成氨,如图乙所示原理可利用N2、H2、CO、水蒸气合成氨。阳极反应式是_______________,离子交换膜中通过的离子是_____(填化学符号)。