题目内容
18.下列有关实验操作对应的现象及对现象的解释或所得出的结论都正确的选项是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浓度为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| B | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未水解 |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈红色 | 原溶液中不含K+ |
| D | 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 | 变浑浊 | 说明该盐是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.先出现蓝色沉淀,说明Ksp[Cu(OH)2]较小;
B.不能排除AgOH的干扰;
C.应透过蓝色钴玻璃观察;
D.也可能为碳酸氢盐.
解答 解:A.溶度积小的先生成沉淀,向浓度为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水先出现蓝色沉淀,说明Ksp[Cu(OH)2]较小,故A正确;
B.溴乙烷与NaOH溶液共热后,应先加入硝酸酸化,否则不能排除AgOH的干扰,故B错误;
C.钾离子的焰色反应应透过蓝色钴玻璃观察,故C错误;
D.某盐溶于盐酸,产生无色无味气体通入澄清石灰水变浑浊,说明生成二氧化碳气体,也可能为碳酸氢盐,故D错误.
故选A.
点评 本题考查化学实验方案评价,涉及焰色反应、溴乙烷的水解、离子检验等知识点,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握实验原理和操作方法.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
8.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)═2NH3(g)△H=-92.6kJ•mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
下列叙述不正确的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.6kJ•mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热 46.3 kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
| A. | 达平衡时,两个容器中NH3的物质的量浓度相等 | |
| B. | 容器①中反应从开始到刚达平衡时用NH3表示的反应速率为v(NH3)=$\frac{1}{30}$mol•L-1•s-1 | |
| C. | 若容器①体积为0.3 L,则达平衡时放出的热量大于46.3kJ | |
| D. | 容器②中反应达到平衡时吸收的热量为Q |
6.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
| 选项 | 化学反应 | 离子方程式 | 评价 |
| A | NaClO溶液中通入过量SO2气体 | ClO-+H2O+SO2═HClO+HSO3- | 正确 |
| B | NH4HSO3溶液中加入等量NaOH | HSO3-+OH-═SO32-+H2O | 错误,OH-能同时与NH4+、HSO3-反应 |
| C | Na2CO3 的水解 | CO32-+H2O?CO2↑+2OH- | 错误,水解反应不加气体符号 |
| D | 用稀硝酸清洗做过银镜反应的试管 | Ag+4H++NO3-═Ag++NO↑+2H2O | 错误,等式两端电荷不守恒 |
| A. | A | B. | B | C. | C | D. | D |
13.制备下列物质的工业生产流程合理的是( )
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂白粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO_{2}}$CH3CHO |
3.生活中碰到的某些问题,常涉及到化学知识,下列说法正确的是( )
| A. | 塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用 | |
| B. | 含乙醇、NaClO、H2O2等消毒液均可以将病毒氧化而达到消毒目的 | |
| C. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 | |
| D. | 碳酸铝是一种应用很广的食品添加剂,可大量添加到馒头、面包等食品中 |
10.下列有关Fe2(SO4)3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:2Fe3++2I-=2Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1mol/L该溶液和足量的Ca充分反应,生成11.2gFe |
8.在含有K+、I-、NO3-、AlO2-、SO32-,且阴离子浓度均为0.1mol/L的溶液中加入等体积浓度为1mol/L的NaHSO4溶液丙充分反应.下列对所得溶液的有关说法正确的是( )
| A. | 浓度最大的离子是Na+ | B. | 溶液显酸性 | ||
| C. | c(K+)=0.05mol/L | D. | 阴离子种类多于阳离子 |
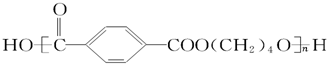 其单体是
其单体是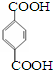 、HO-CH2CH2CH2CH2-OH.
、HO-CH2CH2CH2CH2-OH.


