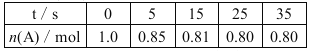
题目内容
【题目】某化学兴趣小组同学设计如下装置(图中药品均足量):
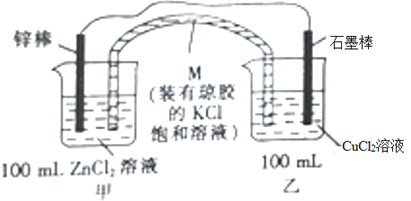
(1)M的名称是_________。
(2)烧杯乙中的现象是_____________________________。
(3)负极的电极反应式为____________________________________________,电池总反应的化学方程式为_____________。
(4)M的作用是向甲、乙两绕杯中提供K+或Cl-,以确保溶液呈电中性。当锌棒质量变化6.5g时,从M中进入装置乙内的离子是__________,其浓度为_____________。
【答案】 盐桥 石墨棒上有紫红色固体析出,溶液颜色变浅 Zn-2e-=Zn2+ Zn+CuCl2=Cu+ZnCl2 K+ 2mol·L-1
【解析】(1)由装置图可得,该化学兴趣小组同学设计的是带盐桥的原电池,所以M是盐桥。
(2)烧杯乙中Cu2+在石墨棒上得电子发生还原反应生成Cu,所以石墨棒上有紫红色固体析出,溶液颜色变浅。
(3)Zn作负极,失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+;该原电池存在自发的氧化还原反应Zn+CuCl2=Cu+ZnCl2,即为电池总反应的化学方程式。
(4)原电池工作时,阳离子移向正极、阴离子移向负极,所以盐桥中K+进入装置乙;由Zn-2e-=Zn2+,当锌棒质量变化6.5g时,转移0.2mol电子,有0.2molK+进入装置乙中,故浓度为:0.2mol÷0.1L=2mol·L-1。

练习册系列答案
相关题目