题目内容
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:
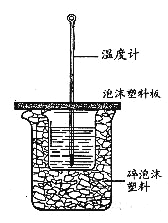
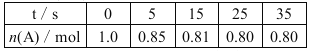
(1)大小烧杯之间填满碎泡沫塑料的作用是___________,做1次完整的中和热测定实验,温度计需使用________次,从实验装置上看,图中缺少的一种玻璃仪器是______________ 。
(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.18J/ (g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ______ , H2SO4与NaOH反应的热化学方程式_______________ 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_______。(填“偏大”、“偏小”、“不受影响”)
【答案】 隔热保温 3次 环形玻璃搅拌棒 -56.8kJ/mol 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(aq) ΔH=-56.8kJ/mol 不相等 相等 偏小
【解析】(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是保温、隔热、减少实验过程中的热量损失;中和热测定实验中需要温度计测量酸、碱和反应后的最高温度三次,所以至少需要使用温度计3次;由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;故答案为:保温、隔热;3;环形玻璃搅拌棒;
(2)量取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。设溶液密度均为1g/mL,生成溶液的比热容c=4.18J/g℃, 则中和热△H=-![]() - kJ/mol=-
- kJ/mol=-![]() kJ/mol=-56.8kJ/mol;H2SO4与NaOH反应的热化学方程式为
kJ/mol=-56.8kJ/mol;H2SO4与NaOH反应的热化学方程式为![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(aq) ΔH=-56.8kJ/mol,故答案为:-56.8kJ/mol;
Na2SO4(aq)+H2O(aq) ΔH=-56.8kJ/mol,故答案为:-56.8kJ/mol; ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(aq) ΔH=-56.8kJ/mol;
Na2SO4(aq)+H2O(aq) ΔH=-56.8kJ/mol;
(3)若用60mL 0.25molL-1 H2SO4溶液跟50mL 0.55molL-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增多,但是中和热是强酸和强碱反应生成1mol水时放出的热,中和热相等;醋酸是弱酸,电离过程需要吸热,所以用50mL0.50molL-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会偏小,故答案为:不相等;相等;偏小。

 优生乐园系列答案
优生乐园系列答案【题目】将牛奶和姜汁混合,待牛奶凝固便成为一种富有广东特色的甜品﹣﹣姜撞奶。为了掌握牛奶凝固所需的条件,某同学在不同温度的等量牛奶中混人一些新鲜姜汁,观察混合物15min,看其是否会凝固,结果如下表。请回答下列问题:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
结果 | 15min后仍未有凝固迹象 | 14min内完全凝固 | 1min内完全凝固 | 1min内完全凝固 | 15min后仍未有凝固迹象 |
(注:用曾煮沸的姜汁重复这项实验,牛奶在任何温度下均不能凝固)
(1)实验证明新鲜姜汁中含有一种酶,其作用是__。
(2)20℃和100℃时,15min后仍未有凝固迹象,说明酶的活性较低,其原因分别是__和__。
(3)若60℃时牛奶在有姜汁和没有姜汁的情况下都可以凝固,当反应进行到t时,向其中加人姜汁。如图,图中能正确表示加姜汁后牛奶凝固随时间变化趋势的曲线是__。

(4)为提高实验的准确度,实验中“不同温度的等量牛奶中混入一些新鲜姜汁”操作中应注意的是__。
(5)有同学说,该实验不能得出姜汁使牛奶凝固的最适温度,请提出解决方案:__。