题目内容
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
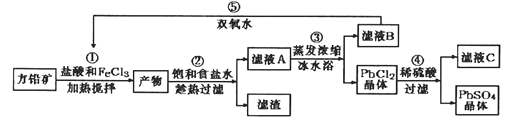
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)①中生成淡黄色沉淀的离子方程式是________________________________________________,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____________________。
(2)用化学平衡移动的原理解释③中使用冰水浴的原因是__________________
(3)上述流程中可循环利用的物质有_______________。
(4)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:
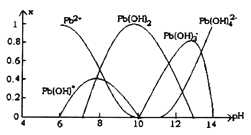
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
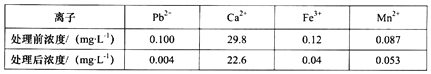
由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_________________________________________。
【答案】 PbS+2Fe3++2Cl-= PbCl2+2Fe2++S 抑制Fe3+、Pb2+的水解 用冰水浴使反应PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出 盐酸和氯化铁 Pb(OH)3+OH= Pb(OH)42 加入试剂,Pb2+的浓度转化率为(0.10.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.120.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好
PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出 盐酸和氯化铁 Pb(OH)3+OH= Pb(OH)42 加入试剂,Pb2+的浓度转化率为(0.10.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.120.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好
【解析】往方铅矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于PbCl2(s)+2Cl(aq)PbCl42△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液A含有PbCl42、Cl、Fe2+、Fe3+等,滤液A蒸发浓缩,冷水浴中冷却,利于平衡逆向进行,析出PbCl2晶体,滤液B中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅晶体,滤液C中含有HCl。
(1). FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成,反应方程式为:2FeCl3+PbS=PbCl2+S+2FeCl2,离子方程式为:PbS+2Fe3++2Cl-= PbCl2+2Fe2++S;Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7,流程中加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是抑制Fe3+、Pb2+的水解,故答案为:PbS+2Fe3++2Cl-= PbCl2+2Fe2++S;抑制Fe3+、Pb2+的水解;
(2).用冰水浴使PbCl2(s)+2Cl(aq)PbCl42△H>0逆向移动,使PbCl42转化PbCl2析出,故答案为:用冰水浴使反应PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
(3). 过氧化氢将滤液B中Fe2+氧化为Fe3+,再循环利用,C溶液中含有HCl,也可以循环利用,故答案为:盐酸和氯化铁;
(4). ①. pH≥13时,Pb(OH) 3浓度减小,Pb(OH) 42浓度增大,Pb(OH) 3与氢氧根离子结合为Pb(OH) 42,反应离子方程式为:Pb(OH) 3 +OH= Pb(OH) 42,故答案为:Pb(OH) 3 +OH= Pb(OH) 42;
②.加入试剂,Pb2+的浓度转化率为(0.10.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.120.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好,故答案为:加入试剂,Pb2+的浓度转化率为(0.10.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.120.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好。