��Ŀ����
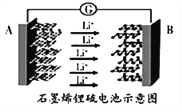
����Ŀ��ij��ѧ����С�齫����������Ʊ���������ʵ�������һ�廯���,ʵ��װ����ͼ��ʾ������˵������ȷ����
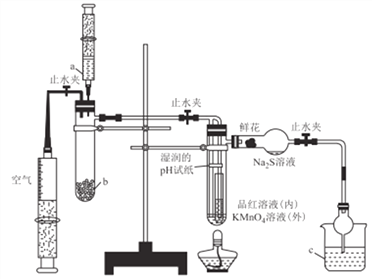
A. a��b��c������ʢװ70%����.Na2SO3���塢NaOH��Һ
B. ʵ��ʱ��ʪ���pH��ֽ���ʻ���Ʒ����Һ��KMnO4��Һ����ɫ��Na2S��Һ���ֵ���ɫ����
C. ����ƿ�֤��SO2ˮ��Һ������,SO2�������ԡ���ԭ�ԡ�Ư����
D. ��ȼ�ƾ��Ƽ���,��֤��SO2ʹƷ����Һ��ɫ���п�����,ʹKMnO4��Һ��ɫ�����п�����
���𰸡�B
��������A. ʵ��ʱ��Ӧ��70%����μӵ�Na2SO3�����У�SO2���ж����壬��NaOH��Һ����β������a��b��c������ʢװ70%���ᡢNa2SO3���塢NaOH��Һ����A��ȷ��B.ʪ���pH��ֻֽ���ɫ������ɫ�����ʻ���Ʒ����Һ��KMnO4��Һ����ɫ��Na2S��Һ���ֵ���ɫ������B����C. ʪ���pH��ֽ��죬�����˶�������ˮ��Һ�����ԣ�KMnO4��Һ��ɫ�������˶�������Ļ�ԭ�ԣ��ʻ���Ʒ����Һ��ɫ�������˶��������Ư���ԣ�Na2S��Һ���ֵ���ɫ�����������˶�������������ԣ���C��ȷ��D. ��ȼ�ƾ��Ƽ��ȣ�Ʒ����Һ�ܿ�ָ���ɫ��֤��SO2ʹƷ����Һ��ɫ���п����ԣ�KMnO4��Һ����ɫ��˵��KMnO4��Һ��ɫ�����п����ԣ���D��ȷ����ѡB��

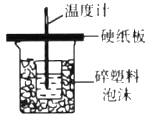
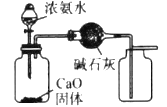
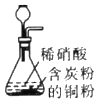
����Ŀ��������ʵ��װ�ý�����Ӧʵ��ܴﵽʵ��Ŀ�ĵ���
ѡ�� | A | B | C | D |
ʵ��װ�� |
|
|
|
|
ʵ��Ŀ�� | ��ɡ���Ȫ��ʵ�� | �ⶨ�к��� | ��ȡ���ռ����﴿����NH3 | ��ȡNO |
A. A B. B C. C D. D
����Ŀ������������գ�
��1��25��ʱ����0.1L 0.2molL��1��HA��Һ�У���0.001mol��HA��������ӣ������Һ��pH= ��
��2��25��ʱ������0.1mol/L��ˮ�м���ϡ��������Һ��pH=7����ʱc��NH4+��=amol/L����c��SO42����= ��
��3�������£�����0.1mol/L��ˮ�м���pH=1�����ᣬ�Ұ�ˮ������������Ϊ1��1����������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳���� ��
��4������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ��������������֪��
��ѧʽ | ���볣����25�棩 |
HCN | K=4.9��10��10 |
CH3COOH | K=1.8��10��5 |
H2CO3 | K1=4.3��l0��7��K2=5.6��10��11 |
�ش���������
25��ʱ���е�Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ������Һ��pH�ɴ�С��˳��Ϊ ��
��NaCN��Һ��ͨ������CO2 �� ��������Ӧ�Ļ�ѧ����ʽΪ�� ��
��5�������£���һ�����pH=12��Ba��OH��2��Һ�У���μ���һ�����ʵ���Ũ�ȵ�NaHSO4��Һ������Һ�е�Ba2+ǡ����ȫ����ʱ����ҺpH=11������Ӧ����Һ���������Ba��OH��2��Һ��NaHSO4��Һ�����֮�ͣ���Ba��OH��2��Һ��NaHSO4��Һ��������� ��