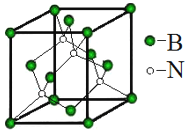
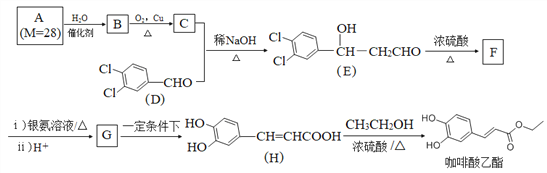
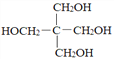
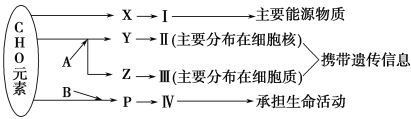
题目内容
【题目】甲醇(CH3OH)是重要的有机化工原料,可用于制取氢气、甲酸甲酯(HCOOCH3)。(1) 在一定条件下用氧气催化氧化甲醇制氢气,原料气中n(O2)/n(CH3OH)对反应的选择性影响如图所示(选择性越大表示生成的该物质越多)。当n(O2)/n(CH3OH)=0.25 时,主要反应的化学方程式为____________,制备H2 时最好控制n(O2)/n(CH3OH)=___________。

(2)甲醇催化脱氢制甲酸甲酯的反应为:2CH3OH(g)![]() HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
①已知 :CO(g)+ l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1
2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1
2CO(g)+2 H2(g)=HCOOCH3(g ) △H3 =-134kJ·mol-1
a=_________________。
②在310℃下,将2mol 甲醇置于VL恒容密闭容器中,反应20 分钟后到达平衡,平衡时甲醇和氢气的分压相等。从开始到平衡时甲醇的平均反应速率为____ mol·L-1·min-1,若平衡时气体总压为P总=5×104Pa,Kp=_______。(已知: Kp是用平衡气体分压代替平衡浓度求得的平衡常数。气体分压=气体总压×气体的物质的量分数)。若在310℃下,将2mol 甲醇置于VL恒压密闭容器中,反应到达平衡时甲醇的分压______氢气的分压(填“>”,“=”或“<”)。
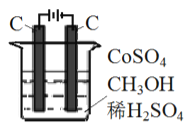
(3) 电解法可消除甲醇对水质造成的污染,原理是: 通电将Co2+ 氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,请写出:
①阴极的电极反应式_______________________________________。
②除去甲醇的离子方程式为_________________________。
【答案】 2CH3OH+O2![]() 2HCHO+2H2O 0.5 46 1/(20V)(或0.05/V) 1×104(或1×104Pa) < 2H++2e-=H2↑ 6Co3++CH3OH+H2O=CO2↑+6H++6Co2+
2HCHO+2H2O 0.5 46 1/(20V)(或0.05/V) 1×104(或1×104Pa) < 2H++2e-=H2↑ 6Co3++CH3OH+H2O=CO2↑+6H++6Co2+
【解析】(1)由图可知当n(O2)/n(CH3OH) =0.25时得到的产物是甲醛,CH3OH与O2发生的主要反应方程式为2CH3OH+O2![]() 2HCHO+2H2O;在制备H2时由于在n(O2)/n(CH3OH) =0.5时选择性最高,所以最好控制n(O2)/n(CH3OH)= 0.5;(2) ①已知:CO(g)+l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1 ;2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1 ;2CO(g)+2 H2(g)=HCOOCH3(g) △H3 =-134kJ·mol-1 ;根据盖斯定律,由②+③-①
2HCHO+2H2O;在制备H2时由于在n(O2)/n(CH3OH) =0.5时选择性最高,所以最好控制n(O2)/n(CH3OH)= 0.5;(2) ①已知:CO(g)+l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1 ;2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1 ;2CO(g)+2 H2(g)=HCOOCH3(g) △H3 =-134kJ·mol-1 ;根据盖斯定律,由②+③-①![]() 得反应2CH3OH(g)
得反应2CH3OH(g)![]() HCOOCH3(g)+2H2(g) △H =△H2+ △H3 - △H1
HCOOCH3(g)+2H2(g) △H =△H2+ △H3 - △H1 ![]() =-386kJ·mol-1 -134kJ·mol-1 +283kJ·mol-1
=-386kJ·mol-1 -134kJ·mol-1 +283kJ·mol-1 ![]() =+46 kJ·mol-1 ,故a=46;
=+46 kJ·mol-1 ,故a=46;
②设平衡时甲醇消耗的物质的量为x,则2CH3OH(g)![]() HCOOCH3(g)+2H2(g)
HCOOCH3(g)+2H2(g)
开始时的物质的量(mol) 2 0 0
改变的物质的量(mol) x 0.5x x
平衡时的物质的量(mol) 2-x 0.5x x
故2-x=x,x=1mol,从开始到平衡时甲醇的平均反应速率为![]() =
=![]() mol·L-1·min-1;平衡时CH3OH、HCOOCH3、H2的物质的量分别为1mol、0.5mol、1mol,Kp=
mol·L-1·min-1;平衡时CH3OH、HCOOCH3、H2的物质的量分别为1mol、0.5mol、1mol,Kp=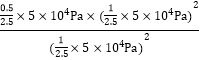 =1×104Pa;(3) 通电后,电解池中水电离产生的氢离子得电子产生氢气,阴极电极反应式为2H++2e-=H2↑;将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
=1×104Pa;(3) 通电后,电解池中水电离产生的氢离子得电子产生氢气,阴极电极反应式为2H++2e-=H2↑;将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案