题目内容
(12分)某工业废水肿含有一定量的Cr2O72-和CrO42-,现
取样该工业废水,检测其中铬的含量。
步骤I:取25. 00 mL废水,加入适后稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,滴人几滴指示剂。
步骤Ⅲ: 用o .1000 mol·L-1Na2S2O3溶液滴定(I2+2Na2 S2O3= 2NaI+Na2S4O6)
达到终点时消耗溶液24. 00 mL。
步骤Ⅳ:将上述反应后的溶液进行如下处理:反应后废液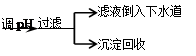
回答下列问题
(1)步骤I加入稀硫酸酸化的目的是 ;
(2)步骤Ⅱ中发生如下反应,请完善并配平离子方程式
该步骤中所加指示剂是 ;
(3)步骤Ⅲ判断滴定达到终点的现象是__ __。
(4)步骤Ⅳ在生产生活中的意义是____ (任答一条);
(5)计算工业废水中铬元素的含量是 mg/L.
(1)使CrO42-尽可能转化为Cr2O72-,为步骤II提供酸性环境
(2)1、6、14H+ 、2 、 3、7 淀粉溶液
(3)溶液深蓝色褪去
(4)防止重金属(Cr)污染(或资源回收利用)
(5)1664
解析试题分析:(1)因为Cr2O72-和CrO42-之间存在平衡2 CrO42-(黄色)+H+═7Cr2O72-(橙色)+H2O,加酸的目的是使CrO42-尽可能转化为Cr2O72-,为步骤II提供酸性环境;
(2)产物中有水生成,所以反应物中有H+存在,根据得失电子守恒,反应物Cr2O72-中Cr的化合价是+6,产物中Cr的化合价是+3,降低6价;反应物中I-的化合价是-1,生成物中I2的化合价是0,升高2价,所以I2的系数是3,I-的系数是6,Cr2O72-的系数是1,Cr3+的系数是2,再根据电荷守恒配平氢离子的系数是14,最后根据元素守恒配平H2O的系数是7;该反应有碘生成,所以用淀粉溶液作指示剂,溶液变蓝色;
(3)步骤Ⅲ是用Na2S2O3溶液滴定I2,碘反应完全后,溶液为无色,所以判断滴定达到终点的现象是溶液深蓝色褪去且半分钟内不恢复;
(4)反应后的废液中含有Cr3+,属于重金属,所以步骤Ⅳ在生产生活中的意义是防止重金属(Cr)污染(或资源回收利用);
(5)根据所给化学方程式与所配方程式可知2 Cr3+~3I2~6Na2 S2O3,所以工业废水中铬元素的质量是24mL×o .1000 mol·L-1×1/3×52g/mol=41.6mg,则工业废水中铬元素的含量是41.6mg/0.025L=1664mg/L。
考点:考查定量实验的分析与计算

在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
氧化还原反应是重要的反应类型,下列有关说法正确的是
| A.1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数) |
| B.原电池的负极发生氧化反应,电解池的阳极发生还原反应 |
| C.Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+=Cu2++Fe2+ |
| D.Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存 |
RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
| A.R3O4,RO,2 :1 | B.RO2,RO, 1:3 |
| C.RO2,R3O4 ,1 : 2 | D.RO2,RO,1 : 4 |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
| A.1:10 | B.1:8 | C.1:6 | D.1:5 |
(12 分)(原创)部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
(2)上表的5种酸进行比较,酸性最弱的是:_______________;HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是 。
(3)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH—先后消耗的酸及酸式酸根依次是:_______________________。
(4)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:_____________________________________________。
(5)下列离子方程式书写正确的是
A. HNO2 + HS— ="=" NO2—+ H2S↑
B. 2HCOOH+SO32— ="=" 2HCOO—+H2O+SO2↑
C. H2SO3+2HCOO— ="=" 2HCOOH+SO32—
D. H2SO3+ SO3 2— ="=" 2HSO3—
(8分)无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式_______________ 。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF6高温3Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
| A.Al是还原剂 | B.氧化产物只有KAlF4 |
| C.每转移6NA电子,得到42 g Si | D.Al元素在KAlF4和K2AlF5中化合价不同 |
(3)在野外,为了迅速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO。这种混合物叫做生氢剂。请写出该反应的化学方程式___________________________。
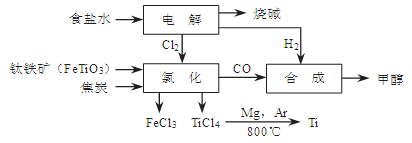
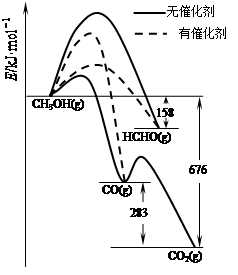
 CH3OH(g)。
CH3OH(g)。