题目内容
(12 分)(原创)部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
(2)上表的5种酸进行比较,酸性最弱的是:_______________;HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是 。
(3)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH—先后消耗的酸及酸式酸根依次是:_______________________。
(4)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:_____________________________________________。
(5)下列离子方程式书写正确的是
A. HNO2 + HS— ="=" NO2—+ H2S↑
B. 2HCOOH+SO32— ="=" 2HCOO—+H2O+SO2↑
C. H2SO3+2HCOO— ="=" 2HCOOH+SO32—
D. H2SO3+ SO3 2— ="=" 2HSO3—
(12 分,每空2分)
(1) HNO2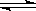 H++ NO2— (2) H2S ;HSO3-。
H++ NO2— (2) H2S ;HSO3-。
(3) H2C2O4、HCOOH、HC2O4- (4) 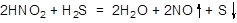
(5) D
解析试题分析:(1)HNO2为弱酸,则电离方程式为:HNO2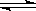 H++ NO2—
H++ NO2—
(2)电离常数越小,则弱酸的酸性越弱,所以上表的5种酸进行比较,酸性最弱的是:H2S ;酸性越强,酸根离子结合H+的能力越弱,所以HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是:HSO3-。
(3)根据电离常数的大小,可知酸性由强到弱的顺序为:H2C2O4、HCOOH、HC2O4-,所以被OH—先后消耗的酸及酸式酸根依次是:H2C2O4、HCOOH、HC2O4-。
(4)HNO2具有强氧化性,H2S具有较强还原性,发生氧化还原反应,生成的沉淀为S,生成的无色气体遇空气立即变为红棕色,则无色气体为NO,所以化学方程式为: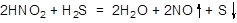
(5)A、HNO2具有强氧化性,与HS?发生氧化还原反应,而不是复分解反应,错误;B、HCOOH的酸性弱于H2SO3,所以HCOOH不能与SO32?反应生成SO2和H2O,错误;C、HSO3?的酸性弱于HCOOH,所以H2SO3与HCOO?反应生成HCOOH和HSO3?,不可能生成SO32?,错误;D、二元弱酸H2SO3与对应的酸根离子SO32?反应生成酸式酸根离子HSO3?,正确。
考点:本题考查弱电解质的电离平衡、酸性强弱的比较及应用、氧化还原反应原理、方程式的书写。

 阅读快车系列答案
阅读快车系列答案已知2Al+2NaOH+2H2O 2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
| A.每生成0.3 mol H2,被还原的水分子数目为0.6 NA |
| B.当有2.7 g Al参加反应时,转移的电子数目为0.3 NA |
| C.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 NA |
| D.溶液中每增加0.1 mol的AlO2-,Na+的数目就增加0.1 NA |
在化学分析实验中,常常用到酸碱滴定、沉淀滴定、氧化还原滴定等。下列属于氧化还原滴定的是
| A.用标准盐酸滴定NaOH溶液 |
| B.用标准KMnO4溶液滴定FeSO4溶液 |
| C.用标准KSCN溶液滴定FeCl3溶液 |
| D.用标准AgNO3溶液滴定NaCl溶液 |
下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的木炭与CO2反应 | D.甲烷在O2中的燃烧反应 |
(14分)连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。
其制备过程如下:
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na2SO3固体和某酸反应制备SO2气体;
③在一定温度下,将足量的SO2气体通入①的溶液中,即有保险粉生成,同时生成一种气体。
(1)写出NaOH的电子式
(2)制备SO2时所选用的酸,你认为下列最适宜选用的是
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
(4)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,则每消耗0.1mol保险粉,理论上可以除去Cr2O72-的物质的量为 mol。
(5)保险粉不稳定,容易分解生成甲、 乙、 丙三种化合物。若将甲、乙两种物质分别配成溶液,在甲溶液中加入稀硫酸,则有淡黄色沉淀和气体丙产生;乙溶液中加入BaCl2溶液和稀盐酸,有气体丙产生,但无白色沉淀。在甲溶液中加入稀硫酸后所发生反应的离子方程式为 保险粉分解的化学方程式为
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。