题目内容
【题目】将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,组成甲、乙两个装置(如图)。下列说法不正确的是

A.甲为原电池,负极反应为Zn-2e-=Zn2+
B.甲为原电池,Fe电极上有气体放出
C.乙为电解池,阴极反应式为2H++2e-=H2↑
D.一段时间后,甲、乙两表面皿中溶液均有红色出现
【答案】B
【解析】
A. 根据图示可知甲为原电池,由于金属活动性Zn>Fe,所以Zn为负极,失去电子,发生氧化反应,负极反应为Zn-2e-=Zn2+,A正确;
B. 根据图示可知甲为原电池,由于电解质溶液为NaCl中性溶液,因此在Fe电极上溶解在溶液中的O2得到电子,发生还原反应,不放出氢气,B错误;
C. 乙为电解池,阴极上溶液中的阳离子得到电子,发生还原反应,由于得到电子能力H+>Na+,所以阴极的电极反应式为2H++2e-=H2↑,C正确;
D. 甲池为原电池,O2得到电子变为OH-;乙池为电解池,由于溶液中H+不断放电产生H2逸出,破坏了水的电离平衡,所以溶液中c(OH-)>c(H+),因此在一段时间后两个溶液中都是c(OH-)>c(H+),滴有酚酞后甲、乙两表面皿中溶液均有红色出现,D正确;
故合理选项是B。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。某工厂对工业污泥中Cr(III)回收与再利用工艺流程如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
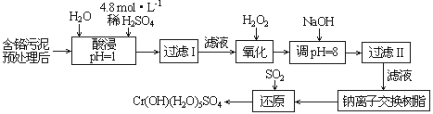
已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH(开始沉淀的pH按金属阳离子浓度为1.0mol·L-1计算)和完全沉淀时溶液的pH,见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.5 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.7 | 11.1 | 8 | 6.7 | 9(>9溶解) |
重铬酸根离子(Cr2O72-)在溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
(1)该工厂对工业污泥中Cr(+3价)回收与再利用工艺流程中,其中一步存在氢氧化铁的沉淀溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq),其溶度积常数表达式为Ksp=__。
Fe3+(aq)+3OH-(aq),其溶度积常数表达式为Ksp=__。
(2)酸浸时,为了提高浸取率可采取的措施是__(至少答一点)。
(3)加入H2O2的作用是__。调节溶液的pH=8是为了除去__离子。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是__。




