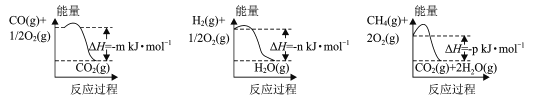
题目内容
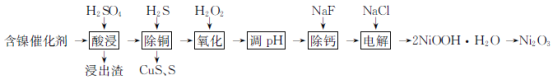
【题目】某科研人员以废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO)为原料回收镍,工艺流程如下:
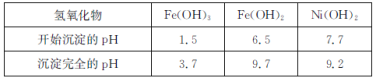
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表:
回答下列问题:
(1)浸出渣主要成分为_________(填化学式)。
(2)“除铜”时,Fe3+与H2S反应的离子方程式为__________________。
(3)“氧化”的目的是将溶液中Fe2+氧化为Fe3+,温度需控制在40~50℃之间,该步骤温度不能太高的原因是_______________________。
(4)“调pH”时,pH的控制范围为_________。
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步,其中第一步是Cl-在阳极被氧化为ClO-,则该电极反应式为_______________________。
【答案】CaSO4(或CaSO4·2H2O)、BaSO4 2Fe3++H2S=2Fe2++S↓+2H+ 温度太高,H2O2受热分解 3.7≤pH<7.7 Cl-+2OH--2e-=ClO-+H2O
【解析】
废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),用H2SO4浸取,过滤得含有Ni2+、Fe3+、Cu2+、Ca2+的溶液,反应产生的大部分Ca2+及Ba2+与SO42-结合形成CaSO4、BaSO4沉淀进入浸出渣中;然后向滤液中再通入H2S除去Cu2+,且使Fe3+被还原成Fe2+,得CuS、S固体,过滤得滤液中含有Ni2+、Fe2+、Ca2+,向该溶液中加入H2O2,可以将Fe2+氧化为Fe3+,然后调整溶液的pH,使Fe3+形成Fe(OH)3沉淀,而Ni2+仍然存在溶液中,加入NaF形成CaF2沉淀除去Ca2+,再加入NaCl后电解得NiOOH,灼烧NiOOH得Ni2O3,CuS、S固体灼烧后用H2SO4进行酸浸得硫酸铜溶液,结晶可得硫酸铜晶体,以此解答该题。
(1)根据上述分析可知浸出渣主要成分为CaSO4(或CaSO4·2H2O)、BaSO4;
(2)向酸浸后的溶液中通入H2S气体,会发生反应Cu2++H2S=CuS↓+2H+,由于溶液中含有的Fe3+具有氧化性,而H2S具有还原性,二者会发生氧化还原反应:2Fe3++H2S=2Fe2++S↓+2H+,产生S单质,故通入H2S气体后得到的滤渣中含有CuS和难溶于水的单质S;
(3)向溶液中加入H2O2进行“氧化”的目的是将溶液中Fe2+氧化为Fe3+,温度需控制在40~50℃之间,该步骤温度不能太高,这是由于H2O2不稳定,温度太高,H2O2受热分解;
(4)经氧化后溶液中存在Ni2+、Fe3+、“调pH”使Fe3+形成Fe(OH)3沉淀,而Ni2+仍然存在溶液中,根据表格数据可知当溶液pH>3.7时Fe3+沉淀完全,而Ni2+开始形成Ni(OH)2沉淀的pH是7.7,因此pH的控制范围为3.7≤pH<7.7;
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步,其中第一步是Cl-在阳极失去电子被氧化,结合溶液OH-产生ClO-和水,则阳极的电极反应式为Cl-+2OH--2e-=ClO-+H2O。