题目内容
13.聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O]是一种新型高效净水剂,广泛应用于工业污染水的处理.(1)聚合硫酸铝铁能够净水的原因是聚合硫酸铝铁溶于水电离的Al3+、Fe3+可以水解形成胶体,具有吸附性.
(2)AlaFeb(OH)m(SO4)n•xH2O中a、b、m、n的代数关系式为3a+3b=m+2n.
(3)为了测定聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810g样品溶于150mL 0.100mol•L-1稀硫酸,恰好完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,以磁力搅拌机搅拌,充分反应后,以0.500mol•L-1Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,再滴定至终点,消耗Na2S2O3溶液20.00mL.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
①步骤二中使用磁力搅拌器进行搅拌的目的是混匀反应物,确保反应完全.
②通过计算确定聚合硫酸铝铁的化学式(写出计算过程).
分析 (1)Al3+、Fe3+水解形成胶体,胶体具有吸附性;
(2)根据化合物中各元素化合价的代数和为0确定这几个字母之间的关系;
(3)①搅拌可以是反应物混合均匀;
②根据消耗的盐酸计算n(OH-),根据与BaCl2反应沉淀的沉淀的质量求出n(SO42-),根据与碘离子反应的关系求出n(Fe3+),根据电荷守恒计算n(Al3+),再根据总质量求出水的质量及物质的量,根据物质的量之比确定化学式.
解答 解:(1)聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O]在水中能够电离出Al3+、Fe3+,Al3+、Fe3+水解形成胶体,胶体具有吸附性,能够吸附水中的悬浮颗粒,从而起到净水的作用;
故答案为:聚合硫酸铝铁溶于水电离的Al3+、Fe3+可以水解形成胶体,具有吸附性;
(2)AlaFeb(OH)m(SO4)n•xH2O中中各元素化合价的代数和为0,所以3a+3b+(-1)×m+(-2)×2=0,所以得3a+3b=m+2n,
故答案为:3a+3b=m+2n;
(3)①搅拌可以是反应物混合均匀,有利于反应物充分接触,使反应物完全反应;
故答案为:混匀反应物,确保反应完全;
②n(OH-)=2n(H2SO4)=0.15L×0.100 mol•L-1×2=0.03mol,
n(SO42-)=n(BaSO4)-n(H2SO4)=$\frac{10.4850g}{233g•mol{\;}^{-1}}$-0.15L×0.100 mol•L-1=0.03mol,
已知:I2+2Na2S2O3=2NaI+Na2S4O6,2Fe3++2I-=2Fe2++I2,则2Fe3+~I2~2Na2S2O3,
n(Fe3+)=n(Na2S2O3)=0.02L×0.500 mol•L-1=0.01mol,
在AlaFeb(OH)m(SO4)n中离子所带电荷守恒,
则n(Al3+)=$\frac{1}{3}$×(0.03mol+0.03mol×2-0.01mol×3)=0.02mol
8.810g样品中水的质量:m(H2O)=8.810g-0.02mol×27g•mol-1-0.01mol×56 g•mol-1-0.03mol×17 g•mol-1-0.03mol×96 g•mol-1=4.32 g,
则n(H2O)=$\frac{4.32g}{18g/mol}$=0.24mol,
所以n(Al3+):n(Fe3+):n(OH-):n(SO42-):n(H2O)=2:1:3:3:24
则硫酸铝铁的化学式为:Al2Fe(OH)3(SO4)3•24H2O;
答:聚合硫酸铝铁的化学式为Al2Fe(OH)3(SO4)3•24H2O.
点评 本题考查了探究物质的组成、胶体的性质、化合物中化合价的关系等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握物质化学式的确定方法.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 液氮的沸点为-195.8℃,远低于常温 | B. | N2在空气中燃烧放热 | ||
| C. | N2的化学性质很稳定 | D. | N2在空气中的体积分数为78% |
| A. | NaHCO3溶液和盐酸;CO32-+2H+═H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | 向碳酸氢铵溶液中加过量的氢氧化钠溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用MnS除去MnCl2溶液中的Cu2+:MnS+Cu2+=CuS+Mn2+ |
| A. | FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O |
| A. | Cu与过量的S混合加热,最终得到CuS | |
| B. | 将氯气通入冷的消石灰中制漂白粉 | |
| C. | 常温下,将27 g A1投入足量18.4 mol•L-1的硫酸中,产生1.5 mol H2 | |
| D. | 将SO2不断通入Ba(OH)2溶液中,最终得到白色沉淀 |
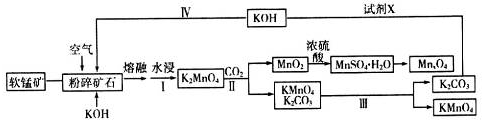
请回答下列问题:
(1)K2MnO4中锰元素的化合价是+6.
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(3)分析下表数据.工业上采用Ⅲ得到较纯净的高锰酸钾,Ⅲ中包含的操作名称是蒸发结晶、过滤、洗涤、干燥.
| 温度/℃ 溶解度/g | 10 | 20 | 30 | 40 | 60 |
| KC2O3 | 107 | 109 | 111 | 114 | 126 |
| KMnO4 | 2.83 | 4.31 | 6.34 | 9.03 | 12.6 |
(5)通过煅烧MnSO4•H2O可制得软磁铁氧体材料MnxO4.下图是煅烧MnSO4•H2O时温度与剩余固体质量变化的曲线.该曲线中A段所表示物质的化学式是MnSO4;MnxO4中x=3.


则下列说法不正确的是( )
| A. | 路线①②③是工业生产硝酸的主要途径 | |
| B. | 路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 | |
| C. | 上述所有反应都是氧化还原反应 | |
| D. | 上述反应中只有③属于氮的固定 |