题目内容
18.下列叙述正确的是( )| A. | Cu与过量的S混合加热,最终得到CuS | |
| B. | 将氯气通入冷的消石灰中制漂白粉 | |
| C. | 常温下,将27 g A1投入足量18.4 mol•L-1的硫酸中,产生1.5 mol H2 | |
| D. | 将SO2不断通入Ba(OH)2溶液中,最终得到白色沉淀 |
分析 A.Cu与S加热生成硫化亚铜;
B.氯气与氢氧化钙反应生成氯化钙和次氯酸钙;
C.常温下,Al遇到浓硫酸会钝化;
D.过量的SO2与Ba(OH)2溶液反应生成亚硫酸氢钙.
解答 解:A.S的氧化性较弱,Cu与S加热生成硫化亚铜,不能得到CuS,故A错误;
B.氯气与氢氧化钙反应生成氯化钙和次氯酸钙,即将氯气通入冷的消石灰中制漂白粉,故B正确;
C.常温下,Al遇到浓硫酸会钝化,所以常温下,将27 g A1投入足量18.4 mol•L-1的硫酸中,不能生成氢气,故C错误;
D.将SO2不断通入Ba(OH)2溶液中,开始生成白色沉淀亚硫酸氢钡,二氧化硫过量,沉淀又溶解生成亚硫酸氢钙,故D错误.
故选B.
点评 本题考查了元素化合物的有关性质,题目难度不大,注意把握常见元素及其化合物的性质,注意反应物的量不同时产物可能不同.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 同温、同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温、同压下,相同体积的气体都含有相同数目的分子 | |
| C. | 在标准状况下,1 mol水的体积约是22.4 L | |
| D. | 1 mol某气体的体积约为22.4 L,该气体所处的状况一定是标准状况 |
9.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4 Na++2Cu(OH)2↓+O2↑ |
6.用下列实验装置和方法进行相应实验,能达到实验目的是( )


| A. | 用图甲装置构成锌-铜原电池 | B. | 用图乙装置除去NO2中的NO | ||
| C. | 用图丙装置制备SO2气体 | D. | 用图丁装置制取干燥的氨气 |
3.下列描述与图象相对应的是( )
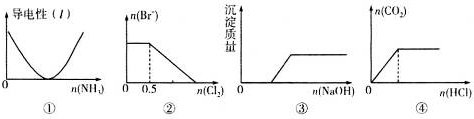

| A. | 图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 | |
| B. | 图②表示向1 L l mol•L-1.FeBr2溶液中通入Cl2时Br-物质的量的变化 | |
| C. | 图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化 | |
| D. | 图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系 |
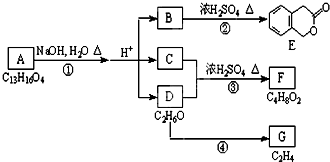 如图中A、B、C、D、E、F、G均为有机化合物.
如图中A、B、C、D、E、F、G均为有机化合物. ;反应①的反应类型是水解反应;
;反应①的反应类型是水解反应; 中任意一种.
中任意一种.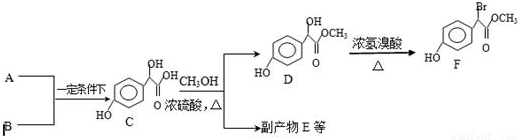
 .
.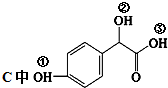 ①、②、③3个-OH的酸性由强到弱的顺序是:
①、②、③3个-OH的酸性由强到弱的顺序是: .
. .
.