题目内容
1.在t℃时,某NaOH稀溶液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12,则(1)该温度下水的离子积常数KW=10-12.
(2)该NaOH溶液的物质的量浓度的精确值是10-b-10-amol•L-1.
(3)在该温度下,将100mL 0.1mol•L-1的稀硫酸与100mL 0.4mol•L-1的NaOH溶液混合后,溶液的pH=11.
(4)该温度下若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前 a与b之间应满足的关系是a+b=14.
分析 在t℃时,某NaOH稀溶液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12,则
(1)该温度下水的离子积常数KW=c(H+).c(OH-);
(2)该NaOH溶液的物质的量浓度的精确值=c(OH-)-c(H+);
(3)在该温度下,将100mL 0.1mol•L-1的稀硫酸与100mL 0.4mol•L-1的NaOH溶液混合后,混合溶液中c(OH-)=$\frac{0.4mol/L×0.1L-0.1mol/L×2×0.1L}{(0.1+0.1)L}$=0.1mol/L,c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$,溶液的pH=-lgc(H+);
(4)该温度下若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,说明酸中n(H+)等于碱中n(OH-).
解答 解:在t℃时,某NaOH稀溶液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12,则
(1)该温度下水的离子积常数KW=c(H+).c(OH-)=10-(a+b)=10-12,故答案为:10-12;
(2)该NaOH溶液的物质的量浓度的精确值=c(OH-)-c(H+)=(10-b-10-a)mol/L,
故答案为:(10-b-10-a);
(3)在该温度下,将100mL 0.1mol•L-1的稀硫酸与100mL 0.4mol•L-1的NaOH溶液混合后,混合溶液中c(OH-)=$\frac{0.4mol/L×0.1L-0.1mol/L×2×0.1L}{(0.1+0.1)L}$=0.1mol/L,c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-12}}{0.1}$mol/L=10-11mol•L-1,溶液的pH=-lgc(H+)=-lg10-11=11,
故答案为:11;
(4)该温度下若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,说明酸中n(H+)等于碱中n(OH-),即100×10-a=1×10b-12,则a+b=14,故答案为:a+b=14.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确已知pH值的碱溶液中c(OH-)的计算方法是解本题关键,难点是酸碱混合溶液pH的计算,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 空气 | B. | 二氧化碳 | C. | 氧气 | D. | 氩气 |
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4 Na++2Cu(OH)2↓+O2↑ |
| A. | c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(OH-) | ||
| C. | c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-) | D. | c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+) |

| A. | 用图甲装置构成锌-铜原电池 | B. | 用图乙装置除去NO2中的NO | ||
| C. | 用图丙装置制备SO2气体 | D. | 用图丁装置制取干燥的氨气 |
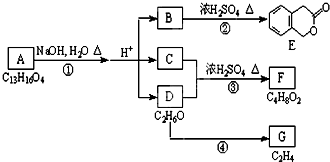 如图中A、B、C、D、E、F、G均为有机化合物.
如图中A、B、C、D、E、F、G均为有机化合物. ;反应①的反应类型是水解反应;
;反应①的反应类型是水解反应; 中任意一种.
中任意一种.