题目内容
2.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
完成并配平溶液颜色由蓝色变为无色的化学反应方程式(如果系数是1,不用填写):
5Cl2+I2+6H2O→2HIO3+10HCl.
(2)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
(3)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为:4.7×10-7,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.
分析 (1)加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸;
(2)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰;
(3)当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$.
解答 解:(1)滴加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸,方程式为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2、I2、6H2O、2、10HCl;
(2)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰,
故答案为:MnSO4;
(3)当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$=$\frac{8.5×1{0}^{-17}}{1.8×1{0}^{-10}}$=4.7×10-7,
故答案为:4.7×10-7.
点评 本题考查氧化还原反应、溶度积的有关计算,题目难度不大,侧重于考查学生对基础知识的应用能力和计算能力,注意把握氧化还原反应原理和溶度积常数的计算方法.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
12.下列气体中.可以用来冷却镁蒸气的是( )
| A. | 空气 | B. | 二氧化碳 | C. | 氧气 | D. | 氩气 |
12.如何解决好碳排放问题是关系到人类可持续发展的重大课题之一.目前,采用较多的方法是对二氧化碳进行捕集封存和富集再利用.下列与二氧化碳有关的叙述正确的是( )
| A. | CO2是形成酸雨的主要物质 | |
| B. | CO2导致温室效应,是一种大气污染物 | |
| C. | CO2(g)+C(s)$\stackrel{高温}{?}$2CO(g)△H>0,高温有利于该反应自发进行 | |
| D. | 实验室常用大理石与稀盐酸或稀硫酸反应制取二氧化碳 |
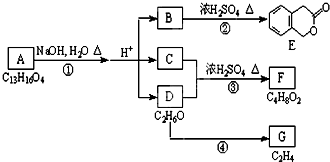 如图中A、B、C、D、E、F、G均为有机化合物.
如图中A、B、C、D、E、F、G均为有机化合物. ;反应①的反应类型是水解反应;
;反应①的反应类型是水解反应; 中任意一种.
中任意一种.
 ;
;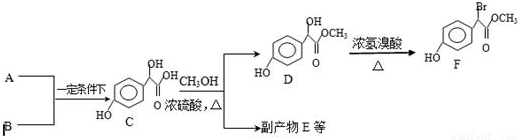
 .
.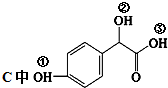 ①、②、③3个-OH的酸性由强到弱的顺序是:
①、②、③3个-OH的酸性由强到弱的顺序是: .
. .
.