题目内容
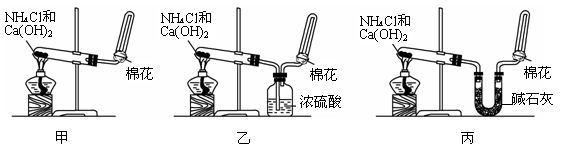
I甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
(1)三位同学制取氨气的化学方程式为:_____________________________________________。
(2)三位同学用上述装置制取氨气时,其中乙同学没有收集到氨(如果他们的实验操作都正确),你认为收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(3)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________
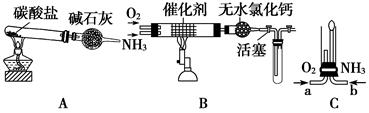
II某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气催化氧化的实验。
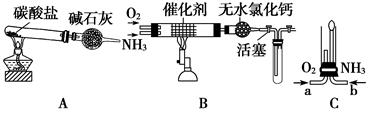
(4)用装置A制取纯净、干燥的氨气,大试管内是碳酸盐;碱石灰的作用是__________________________________。
(5)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是_______________;试管内气体变为红棕色,该反应的化学方程式是_________________。
1)2NH4Cl + Ca(OH)2 ==CaCl2 + 2NH3↑+ 2H2O
(2) 2NH3 + H2SO4 =(NH4)2SO4
(3)将湿的红色石蕊试纸放在管口;变蓝则已满
(4)吸收CO2和水蒸气
(5)4NH3 + 5O2 ="==4NO" + 6H2O 2NO + O2 =2NO2
【解析】
试题分析:(1)三位同学都是利用氯化铵与氢氧化钙反应制备氨气,其化学方程式为
2NH4Cl + Ca(OH)2 ==CaCl2 + 2NH3↑+ 2H2O;(2)氨气能够与浓硫酸反应,所以乙同学收不到氨气,即发生了如下反应:2NH3 + H2SO4 =(NH4)2SO4 ;(3)检验氨气是否收集满的方法是:将湿的红色石蕊试纸放在管口;变蓝则已满;(4)由碳酸盐与氯化铵反应生成了二氧化碳和水,所以碱石灰的作用是吸收CO2和水蒸气;(5)氨催化氧化的化学方程式是:4NH3 + 5O2 ="==4NO" + 6H2O,NO可以被氧气氧化为红棕色的二氧化氮,其化学方程式为2NO + O2 =2NO2。
考点:实验室制备氨气
点评:本题考查了实验室制备氨气的基础知识,是高考考查的重点,本题不难。

某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
相对分子质量 | 32 | 122 | 136 |
Ⅰ.合成苯甲酸甲酯粗产品
在烧瓶中加入12.2g 苯甲酸和20mL 甲醇(密度约0.79g/mL) ,再小心加入3mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)该反应中浓硫酸的作用?????? ,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:?????????? ,甲醇过量的原因???????????????? 。?
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是?????? 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用???????? 装置(填“甲”、“乙”、“丙”)。 ?? 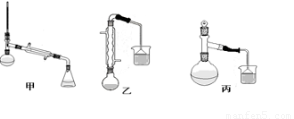
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为???? ,操作II为????? 。

(5)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是??????????????? 。
(6)苯甲酸甲酯的产率为???????? 。