题目内容
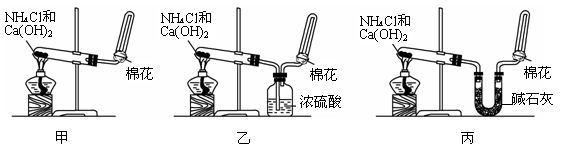
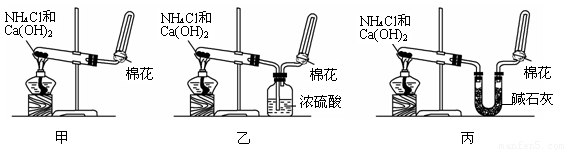
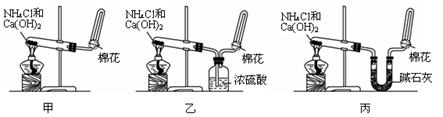
I甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
(1)三位同学制取氨气的化学方程式为:_____________________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是__________________________________.
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是___________填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________
__________________________________________________________________________________
_______________________________________________________________________________。
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是___________(填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4CL固体代替NH3?______________(填“能”或“不能”)。
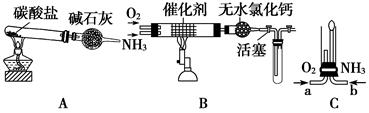
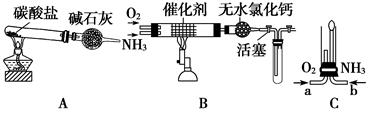
II资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(6)用装置A制取纯净、干燥的氨气,大试管内是碳酸盐;碱石灰的作用是__________________________________。
(7)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是__________________;试管内气体变为红棕色,该反应的化学方程式是_________________。
(8)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是________,其理由是_____________。
②氨气燃烧的化学方程式是______________________________。
(1)2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O (2)氨气的密度比空气小,且氨气极易溶于水
CaCl2 + 2NH3↑+ 2H2O (2)氨气的密度比空气小,且氨气极易溶于水
(3)乙 2NH3 + H2SO4=(NH4)2SO4 (4)将湿的红色石蕊试纸放在管口;变蓝则已满
(5)丙 不能 (6)吸收CO2和水蒸气 (7)4NH3 + 5O2 4NO + 6H2O 2NO + O2=2NO2
4NO + 6H2O 2NO + O2=2NO2
(8) ①先通氧气后通氨气 若先通氨气,氨气在空气中不能燃烧,散发到空气中污染大气
② 4NH3 + 3O2 2N2 + 6H2O
2N2 + 6H2O
解析试题分析:(1)根据所用的药品可知,制备氨气的方程式应该是2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O。
CaCl2 + 2NH3↑+ 2H2O。
(2)由于氨气的密度比空气小,且氨气极易溶于水,所以可以用向下排空气法收集氨气。
(3)氨气是碱性气体,不能用浓硫酸干燥,否则得不到氨气,反应的化学方程式是2NH3 + H2SO4=(NH4)2SO4。
(4)氨气是碱性气体,溶于水显碱性,据此可以判断,即将湿的红色石蕊试纸放在管口,变蓝则已满。
(5)由于碳酸氢铵分解生成氨气的同时还有水和CO2生成,而丙中的碱石灰可以吸收水和CO2,所以丙装置可以得到氨气;由于氯化铵分解生成氨气和氯化氢,冷却后二者又化合生成氯化铵,得不到氨气。
(6)碳酸盐分解会生成水和CO2,所以碱石灰的作用是吸收CO2和水蒸气。
(7)在催化剂的作用下,氨气被氧化生成NO和水,反应的化学方程式是4NH3 + 5O2 4NO + 6H2O。生成的NO极易被氧化生成NO2,所以的化学方程式是2NO + O2=2NO2。
4NO + 6H2O。生成的NO极易被氧化生成NO2,所以的化学方程式是2NO + O2=2NO2。
(8)①若先通氨气,氨气在空气中不能燃烧,散发到空气中污染大气,所以应该先通入氧气。
②氨气燃烧生成氮气和水,所以反应的化学方程式是4NH3 + 3O2 2N2 + 6H2O。
2N2 + 6H2O。
考点:考查氨气的制备、收集、验满、性质以及有关方程式的书写
点评:该题是高考中的常见题型,试题综合性强,对学生的要求高,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。

 名校课堂系列答案
名校课堂系列答案某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
相对分子质量 | 32 | 122 | 136 |
Ⅰ.合成苯甲酸甲酯粗产品
在烧瓶中加入12.2g 苯甲酸和20mL 甲醇(密度约0.79g/mL) ,再小心加入3mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)该反应中浓硫酸的作用?????? ,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:?????????? ,甲醇过量的原因???????????????? 。?
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是?????? 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用???????? 装置(填“甲”、“乙”、“丙”)。 ?? 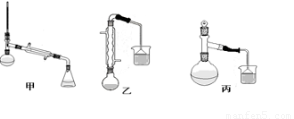
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为???? ,操作II为????? 。

(5)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是??????????????? 。
(6)苯甲酸甲酯的产率为???????? 。