题目内容
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
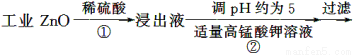
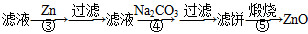
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
(1)Fe2+和Mn2+ MnO4—+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4—+3Mn2++2H2O=5MnO2↓+4H+ 铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质
(2)置换反应 镍
(3)取少量水洗液于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净
(4)1
【解析】从分析整个流程图入手,明确每步发生的反应,从而解决相关问题。
(1)在反应②中,通过调节溶液的pH,高锰酸钾能将溶液中的Fe2+氧化为Fe3+,将
Mn2+氧化为MnO2而除去;若溶液的pH过低,Fe2+、Mn2+将很难生成沉淀而除去。
(2)第一次过滤后的滤液中含有的阳离子有Zn2+、Ni2+、H+等,加入锌后可将Ni置换出来,故滤渣中还含有金属镍。
(3)反应④生成的沉淀为ZnCO3,同时生成Na2SO4,若沉淀未洗涤干净,洗涤液中应含有SO42—和Na+,故只要对洗涤液中是否含有SO42—进行检验即可。
(4)煅烧过程中ZnCO3、Zn(OH)2均发生分解反应生成ZnO,根据关系式ZnCO3·xZn(OH)2~(x+1)ZnO,可得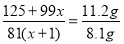 ,故x=1。
,故x=1。

菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
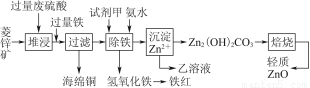
请结合下表数据,回答问题:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.3 | 9.7 |
Fe3+ | 1.5 | 3.2 |
Zn2+ | 6.2 | 8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/mol·L-1 | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=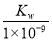 mol·L-1
mol·L-1
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水?约1∶2?,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
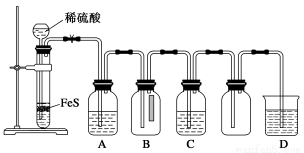
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| 实验操作 | 实验现象 |
实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
已知:电离平衡常数:
H2S Kal=1.3×10-7,Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8
①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。
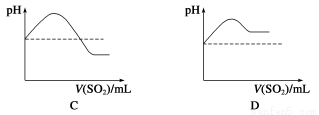
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。

(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。