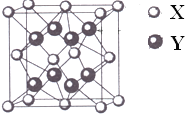
题目内容
【题目】(1)请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式并配平。
________+________===________+________+________+________H2O
(2)反应物中发生氧化反应的物质为________,被还原的元素是________。
(3)反应中1 mol氧化剂得到________mol电子。
【答案】(8分) (1)FeSO4+HNO3![]() Fe(NO3)3+Fe2(SO4)3+N2O+H2O(2分)
Fe(NO3)3+Fe2(SO4)3+N2O+H2O(2分)
(2)FeSO4N (各2分) (3)4 (2分)
【解析】
试题(1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,可得:FeSO4+HNO3![]() Fe(NO3)3+Fe2(SO4)3+N2O+H2O。
Fe(NO3)3+Fe2(SO4)3+N2O+H2O。
(2)还原剂FeSO4发生氧化反应,化合价降低的N元素被还原。
(3)反应中N元素化合价由+5价降低到+1价,则1mol氧化剂得到4mol电子。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】I.汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。汽车内燃机工作时发生反应:N2(g)+O2(g)![]() 2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
(1)5 min内该反应的平均速率v(NO)=___________;在T℃时,该反应的平衡常数值为_________。
(2)反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)___________。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(3)已知:ⅰ.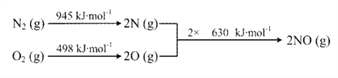
ⅱ. N2(g) + 2O2(g) === 2NO2(g) ΔH= + 68 kJ·mol-1
结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:_____________________。
II. 含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(4)雾霾中能形成酸雨的物质是_____________
(5)NaClO2溶液可以吸收SO2、NO。在NaClO2溶液中通入含有SO2和NO的气体,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式________________________
增大压强,NO的转化率______(填“提高”“不变”或“降低”)。
②由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)。原因除了SO2溶解性大于NO,还可能是___________________
(6)如图电解装置可将SO2、NO转化为(NH4)2SO4,
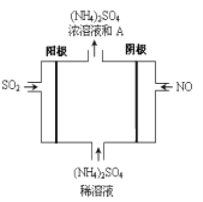
①阴极的电极反应式是______________________________
②SO2、NO通入电解装置中的体积比为___________________