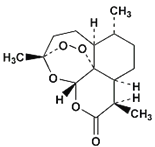
题目内容
【题目】某强酸性溶液X中仅含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断合理的是
A. 根据上述连续实验不能确定溶液X中是否含有Fe3+
B. 沉淀H为Al(OH)3、BaCO3的混合物
C. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
D. 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05mol·L-1
【答案】A
【解析】因为加入过量氢氧化钠后有沉淀生成,后加入过量的二氧化碳有沉淀,说明原溶液中有铝离子存在,生成氢氧化铝沉淀,生成碳酸氢钡,没有碳酸钡沉淀,所以亚硫酸根离子和碳酸根离子不存在。加入过量的硝酸钡溶液,有气体生成,说明溶液中有具有还原性的离子存在,即有亚铁离子,有沉淀生成,说明溶液中有硫酸根离子,没有钡离子。加入氢氧化钠有气体生成,所以溶液中的有铵根离子。所以溶液中肯定有铵根离子,铝离子,亚铁离子,硫酸根离子。不能确定是否有铁离子。气体A为NO,根据3Fe2+~NO,可以计算出![]() ,
,![]() 。答案选A。
。答案选A。

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目