题目内容
4.有200mL氯化镁和氯化铝混合液,其中c(Mg2+)为0.2mol•L-1,c(Cl-)为1.3mol•L-1,要使沉淀量达最大值,需加4mol•L-1NaOH溶液的体积为( )| A. | 20mL | B. | 45mL | C. | 65mL | D. | 80mL |
分析 根据MgCl2和AlCl3的混合溶液与碱的反应可知,要使沉淀量达最大值,溶液溶质只有NaCl,结合原子守恒及V=$\frac{n}{c}$计算.
解答 解:由MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl可知,要使沉淀量达最大值,溶液溶质只有NaCl,n(NaOH)=n(Cl-)=0.2L×1.3mol/L=0.26mol,则需加4mol•L-1NaOH溶液的体积为$\frac{0.26mol}{4mol/L}$=0.065L=65mL,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
14.某可逆反应:A(g)+3B(g)?2C(g);△H<0.有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1 kJ;在相同条件下,向乙容器中加入2mol C达到平衡时吸收热量为Q2kJ;已知Q2=3Q1.下列叙述不正确的是( )
| A. | 乙中C的转化率为75% | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆 | |
| C. | 在该条件下,反应 2C(g)?A(g)+3B(g)的平衡常数为27×1.54(mol/L)2 | |
| D. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+Q2kJ/mol |
12.如图是电解NaCl溶液(加有酚酞)装置,其中c、d为石墨电极.下列有关的判断正确的是( )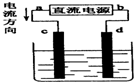

| A. | 电解过程中,d电极附近溶液变红 | |
| B. | c电极上的电极反应式为:2H++2e-=2H2↑ | |
| C. | a为负极、d为阳极 | |
| D. | 电解过程中,氯离子浓度不变 |
9.已知甲、乙装置中的电解质溶液足量,盐桥中盛装饱和氯化钾溶液,用琼脂固定,下列说法正确的是( )
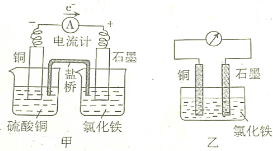

| A. | 甲、乙装置中的负极(或正极)反应式不同 | |
| B. | 放电少许时间后,甲、乙装置石墨极质量均增加 | |
| C. | 放电少许时间后,甲装置左边烧杯中含有两种溶质 | |
| D. | 甲、乙装置的能量转化形式不同 |
5.以下离子检验正确的是( )
| A. | 检验试液中的SO42-:试液$\stackrel{BaCl_{2}溶液}{→}$ 白色沉淀$\stackrel{HCl溶液}{→}$ 白色沉淀 | |
| B. | 检验试液中的Cl-:试液$\stackrel{稀H_{2}SO_{4}}{→}$无沉淀$\stackrel{AgNO_{3}溶液}{→}$ 白色沉淀 | |
| C. | 检验试液中的Fe2+:试液$\stackrel{氯水}{→}$无明显现象$\stackrel{KSCN溶液}{→}$血红色溶液 | |
| D. | 检验试液中的NH4+:试液$→_{供热}^{NaOH溶液}$气体逸出$→_{石蕊试纸}^{湿润的红色}$ 试纸变蓝 |
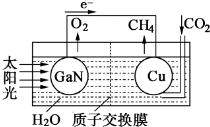 ,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(填“盐酸”或“硫酸”).
,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(填“盐酸”或“硫酸”).
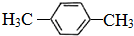 .(相对原子量:C-12 H-1)
.(相对原子量:C-12 H-1)