题目内容
16.过量的Cl2通人NaBr和NaI混合液中,然后将溶液蒸干、灼烧剩余残渣,最后残留物的化学式为NaCl,有关离子方程式为:Cl2+2Br-=2Cl-+Br2、Cl2+2I-=2Cl-+I2.分析 卤族元素氧化性强弱顺序是Cl2>Br2>I2,所以向NaBr、NaI的混合液中通入足量的氯气,氯气和NaBr、NaI发生置换反应生成溴和碘,溴易挥发、碘易升华,据此分析解答.
解答 解:卤族元素氧化性强弱顺序是Cl2>Br2>I2,所以向NaBr、NaI的混合液中通入足量的氯气,氯气和NaBr、NaI发生置换反应生成溴和碘,同时生成NaCl,离子方程式:Cl2+2Br-=2Cl-+Br2、Cl2+2I-=2Cl-+I2;
溴易挥发、碘易升华,所以将溶液蒸干灼烧得到的残留物是NaCl,
故答案为:NaCl;Cl2+2Br-=2Cl-+Br2、Cl2+2I-=2Cl-+I2.
点评 本题考查了卤族元素性质及置换反应,明确物质的性质是解本题关键,注意溴易挥发、碘易升华,题目难度不大.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | 钠在常温下不容易被氧化 | |
| D. | 石蕊试液中加入Na2O2粉末,先变蓝后褪色,并有气泡生成 |
4.有200mL氯化镁和氯化铝混合液,其中c(Mg2+)为0.2mol•L-1,c(Cl-)为1.3mol•L-1,要使沉淀量达最大值,需加4mol•L-1NaOH溶液的体积为( )
| A. | 20mL | B. | 45mL | C. | 65mL | D. | 80mL |
1.ClO3F的结构属于( )
| A. | 线型 | B. | 平面四边 | C. | 平面三角 | D. | 四面体 |
8.对于0.1mol•L-1NH4Cl溶液,下列说法正确的是( )
| A. | 稀释后溶液pH降低 | B. | 通入少量HCl,c(NH4+)不变c(Cl-)增大 | ||
| C. | c(NH4+)+c(OH-)<c(Cl-)+c(H+) | D. | c(Cl-)>c(H+)>c(NH4+) |
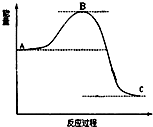 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$2SO3(g)反应过程的能量变化如图所示.请回答下列问题: 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.