题目内容
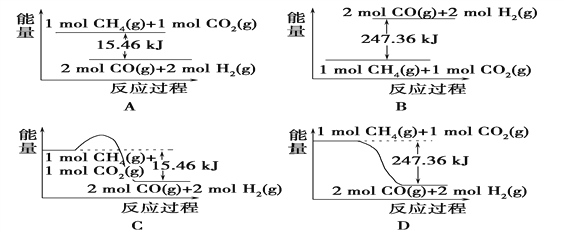
【题目】Ⅰ.甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
(1)下图能表示该反应过程中能量变化的是________(填字母)。
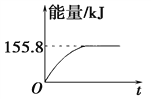
(2)若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为________。
Ⅱ. CO和H2也可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
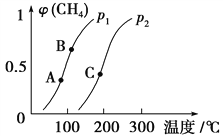
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
(2)100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定 b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2) d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
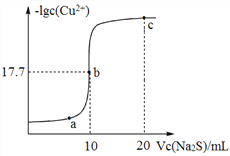
Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。常温下,现向100 mL 0.1 mol·L1 NH4HSO4溶液中滴加0.1 mol·L1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
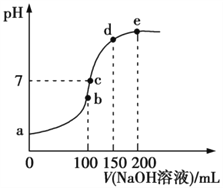
(1)b点时,溶液呈酸性的原因是____________________________。
(2)在c点,溶液中各离子浓度的关系正确的是____。
A.c(H+)+c(Na+)+c(NH4+)=c(OH)+2c(SO42-)
B.c(Na+)> c(NH4+)> c(SO42-)>c(H+)=c(OH)
C.c(Na+)> c(SO42-)> c(NH4+)>c(H+)=c(OH)
D.c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH)
Ⅳ.以H2、O2、熔融Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2。
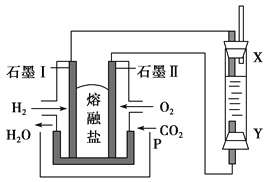
(1)石墨Ⅰ电极上的电极反应式为_________________________。
(2)通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是________(填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作电解液
C.阴极发生的反应是2H2O+2e-===H2↑+2OH-
D.白色沉淀只能在阳极上产生
【答案】 D 63.0% < KA<KB<KC ac NH4+水解使溶液呈酸性 AC H2-2e-+CO![]() ===CO2+H2O BC
===CO2+H2O BC
【解析】Ⅰ.(1) 1 g CH4完全反应可释放15.46 kJ的热量,则1mol甲烷即16g甲烷完全反应可释放15.46 kJ×16=247.36kJ的热量,由于反应物总能量高于生成物总能量,因此选项D符合,答案选D。(2)根据图像可知平衡时放热是155.8kJ,所以根据(1)中数据可知消耗甲烷是155.8/247.36=0.63mol,所以CH4的转化率为63.0%;
Ⅱ. CO和H2也可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
(1)正反应是体积增大的可逆反应,增大压强平衡向逆反应方向进行,甲烷的转化率降低,所以根据图像可知p1<p2。平衡常数只与温度有关系,正反应吸热,升高温度平衡向正反应方向进行,平衡常数增大,所以A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为KA<KB<KC。(2)a.正反应体积增加,当容器的压强恒定时反应达到平衡状态,a正确;b.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内气体密度恒定不能说明反应达到平衡状态,b错误;c.3v正(CH4)=v逆(H2)表示正逆反应速率相等,反应达到平衡状态,c正确;d.单位时间内消耗0.1 mol CH4同时一定生成0.3 mol H2,不能说明,d错误,答案选ac;
Ⅲ.(1)b点时加入100nL氢氧化钠,生成硫酸钠和硫酸铵,铵根水解溶液显酸性;(2)在c点溶液显中性,则A.根据电荷守恒可知c(H+)+c(Na+)+c(NH4+)=c(OH)+2c(SO42-),A正确;B.c是硫酸钠、硫酸铵和一水合氨的混合溶液,则c(Na+)>c(SO42-)> c(NH4+)>c(H+)=c(OH),B错误;C.根据B中分析可知C正确;D.根据B中分析可知D错误,答案选AC;
Ⅳ.(1)石墨Ⅰ通入氢气,是负极,电极上的电极反应式为H2-2e-+CO32-=CO2+H2O。(2)A.要制备氢氧化亚铁,则阳极材料必须是铁,阴极不一定是铁,A错误;
B.阳极产生的亚铁离子结合氢氧根转化为氢氧化亚铁,则可以用NaOH溶液作电解液,B正确;C.阴极发生得到电子的还原反应,即反应是2H2O+2e-=H2↑+2OH-,C正确;D.电解池中阳离子向阴极移动,与氢氧根结合生成白色沉淀氢氧化亚铁,D错误,答案选BC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)=0.24 mol
D. 该温度下此反应的平衡常数:K=1.44