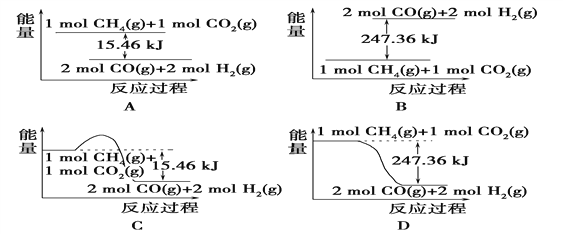
【题目】Ⅰ.甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
(1)下图能表示该反应过程中能量变化的是________(填字母)。
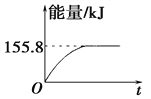
(2)若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为________。
Ⅱ. CO和H2也可由反应CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
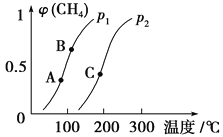
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
(2)100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定 b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2) d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。常温下,现向100 mL 0.1 mol·L1 NH4HSO4溶液中滴加0.1 mol·L1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
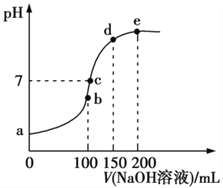
(1)b点时,溶液呈酸性的原因是____________________________。
(2)在c点,溶液中各离子浓度的关系正确的是____。
A.c(H+)+c(Na+)+c(NH4+)=c(OH)+2c(SO42-)
B.c(Na+)> c(NH4+)> c(SO42-)>c(H+)=c(OH)
C.c(Na+)> c(SO42-)> c(NH4+)>c(H+)=c(OH)
D.c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH)
Ⅳ.以H2、O2、熔融Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2。
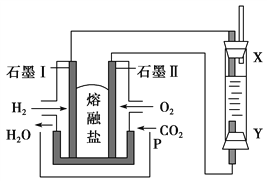
(1)石墨Ⅰ电极上的电极反应式为_________________________。
(2)通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是________(填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作电解液
C.阴极发生的反应是2H2O+2e-===H2↑+2OH-
D.白色沉淀只能在阳极上产生







