题目内容
【题目】随着能源技术的发展,科学家们将目光聚焦于锂的开发与研究。
(1)锂元素的性质与原子结构密切相关。写出锂的原子结构示意图:______。
(2)根据元素周期律推断:
①锂与水反应的化学方程式是_______。
②在碱金属元素的最高价氧化物对应的水化物中, LiOH的碱性最_______(填“强”或“弱”)。
(3)已知:M(g) → M+(g)+e- H(M代表碱金属元素)
元素 | Li | Na | K | Rb | Cs |
H(kJ/mol) | +520 | +496 | +419 | +403 | +376 |
①根据以上数据,元素的金属性与H的关系是_________。
②从原子结构的角度解释①中结论:__________。
(4)海水中有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如下图所示:
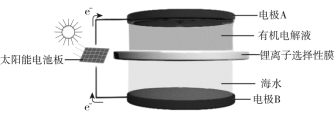
①金属锂在电极______(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是___________。
【答案】![]() 2Li + 2H2O = 2LiOH + H2↑ 弱 同一主族,金属活动性越强(或弱),H越小(或大) 从Li→Cs,随着质子数递增,电子层数增多,原子半径增大,原子失电子能力增强,H减小 A 2Cl- - 2e- = Cl2↑、4OH- - 4e- = O2 + 2H2O
2Li + 2H2O = 2LiOH + H2↑ 弱 同一主族,金属活动性越强(或弱),H越小(或大) 从Li→Cs,随着质子数递增,电子层数增多,原子半径增大,原子失电子能力增强,H减小 A 2Cl- - 2e- = Cl2↑、4OH- - 4e- = O2 + 2H2O
【解析】
(1)Li是三号元素,可据此画出其原子结构;
(2)Li是碱金属中金属性最弱的元素;
(3)①根据表格中的数据分析即可;
②同一主族,自上而下,原子半径越大,原子核对最外层电子的吸引力越弱,原子越容易失去电子;
(4)①要从海水中提炼Li,则Li原本在海水中,由于锂离子选择性膜只允许Li+通过,故可以推出Li+在A极放电生成Li;
②海水中含有大量的Cl-,故气体之一为Cl2,同时,还能产生O2,据此可以推出相应的电极反应。
(1)Li是三号元素,其原子结构为![]() ;
;
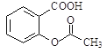
(2)①Li属于碱金属,其和水反应的方程式为2Li+2H2O=2LiOH+H2↑;
②在碱金属元素中,Li的金属性最弱,故LiOH的碱性也最弱;
(3)①从图中可以分析得到,同一主族,金属活动性越强(或弱),H越小(或大);
②从Li→Cs,随着质子数递增,电子层数增多,原子半径增大,原子核对最外层电子的吸引力减小,原子失电子能力增强,H减小;
(4)①要从海水中提炼Li,则Li原本在海水中,由于锂离子选择性膜只允许Li+通过,故可以推出Li+在A极放电生成Li;
②海水中含有大量的Cl-,故有Cl2生成,相应的电极反应为:2Cl--2e-=Cl2↑,海水中在阳放电产生气体的离子还有OH-,故另外一种气体为O2,相应的电极反应为:4OH- -4e-=O2↑+2H2O。