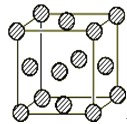
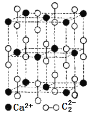
题目内容
【题目】根据下图,下列判断中正确的是
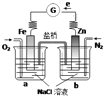
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯b中发生反应为Zn-2e-=Zn2+
【答案】D
【解析】
试题分析:A、原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铁活泼,据此可知,锌是负极,失去电子,生成锌离子。铁是正极,溶液中的氧气得到电子,向烧杯a中加入少量K3[Fe(CN)6]溶液,得不到蓝色沉淀,A错误;B、氧气得到电子,电极反应式为O2+4H++4e-=2H2O,溶液pH升高,B错误;C、电子不能通过溶液传递,只能在外电路通过导线传递,C错误;D、锌是负极,烧杯b中发生反应为Zn-2e-=Zn2+,D正确,答案选D。

练习册系列答案
相关题目