题目内容
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
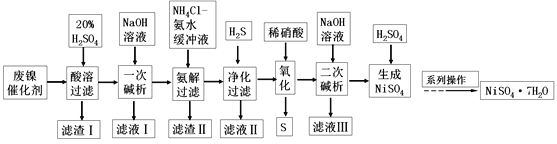
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为了提高浸取率,可采取的措施有________(任写出一条)。
(2)“滤渣I”的主要成分是_________。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为__________。
(4)“氨解”的目的为___,“净化”时加入的H2S的目的是将镍元素转化为____沉淀。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱析”时,若使溶液中的Ni2+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于_______(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-。电解时阳极的电极反应式为________,离子交换膜(b)为__________(填“阴”或“阳”)离子交换膜。
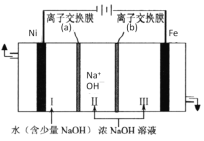
【答案】升高温度、将废镍催化剂粉碎、搅拌等 SiO2 Cr3++4OH-=CrO2-+2H2O 除去Fe3+ NiS 3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O 1.4×10-5mol/L Fe-6e-+8OH-=FeO42-+4H2O 阴
【解析】
废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍,加入20%的硫酸酸溶,NiCO3、Fe2O3、Cr2O3反应进入溶液中,SiO2不能反应,过滤,滤渣Ⅰ为SiO2,滤液加入NaOH溶液进行一次碱析,滤液Ⅰ含有CrO2-,沉淀加入氯化铵、氨水缓冲液,由信息②可知滤渣Ⅱ为Fe(OH)3,过滤得到的滤液含有[Ni(NH3)6]2+,“净化”时通入的H2S,可以将镍元素转化为NiS沉淀,加入硝酸氧化,可生成S和Ni2+,加入氢氧化钠生成Ni(OH)2,过滤后加入硫酸可得到硫酸镍,经蒸发浓缩、冷却结晶得到硫酸镍晶体,以此解答该题。
(1)“酸溶”时为了提高浸取率,可以先将废镍催化剂粉碎,以增大固体表面积,或进行搅拌,并在加热条件下使废镍催化剂与20%硫酸充分反应等;
(2)“滤渣Ⅰ”主要成分为二氧化硅;
(3)Cr(OH)3难溶于水,Cr(OH)3是两性氢氧化物,可以与过量的NaOH溶液发生反应产生CrO2-,则含铬微粒发生反应的离子方程式为Cr3++4OH-=CrO2-+2H2O;
(4)加入氯化铵和氨水的缓冲液,可生成Fe(OH)3沉淀,同时生成[Ni(NH3)6]2+,达到除去Fe3+的目的;“净化”时通入的H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为[Ni[Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑;
(5)“氧化”时HNO3将NiS氧化为S单质,HNO3被还原为NO,发生反应的离子方程式为3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O,从而可除去硫,生成镍离子;
(6)离子浓度≤1×10-5mol/L时,离子沉淀完全,已知Ni(OH)2的Ksp=2×10-15,则c(OH-)=![]() mol/L=1.4×10-5mol/L;
mol/L=1.4×10-5mol/L;
(7)电解池中阳极发生氧化反应,依据题意可知铁在阳极失去电子,碱性环境下生成高铁酸根离子FeO42-,阳极的电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,离子交换膜(b)为阴离子交换膜,可使氢氧根离子进入阳极区。

【题目】已知反应2X(g)+Y(g)2Z(g),某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定不同时间内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.其他条件不变,将X的物质的量改为10mol,则可得到4molZ
C.6min时,容器中剩余1.4molY
D.反应在5.5min时,![]()
【题目】随着能源技术的发展,科学家们将目光聚焦于锂的开发与研究。
(1)锂元素的性质与原子结构密切相关。写出锂的原子结构示意图:______。
(2)根据元素周期律推断:
①锂与水反应的化学方程式是_______。
②在碱金属元素的最高价氧化物对应的水化物中, LiOH的碱性最_______(填“强”或“弱”)。
(3)已知:M(g) → M+(g)+e- H(M代表碱金属元素)
元素 | Li | Na | K | Rb | Cs |
H(kJ/mol) | +520 | +496 | +419 | +403 | +376 |
①根据以上数据,元素的金属性与H的关系是_________。
②从原子结构的角度解释①中结论:__________。
(4)海水中有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如下图所示:
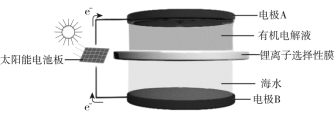
①金属锂在电极______(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是___________。
【题目】气体的自动化检测中常常应用根据原电池原理设计的传感器。下图为电池的工作示意图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。
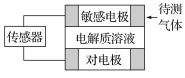
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-===2Cl-
C. 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2和CO体积分数相同的两份空气样本时,传感器上电流大小、方向相同