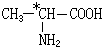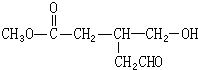题目内容
17.下列分子或离子与SO42-互为等电子体的是( )| A. | PCl5 | B. | CCl4 | C. | NF3 | D. | NH4+ |
分析 具有相同原子数和价电子数的微粒互称为等电子体.它们具有相似的结构特征.
解答 解:SO42-含有5个原子,32个价电子,
PCl5、NF3原子数分别为6、4,都不是SO42-的等电子体;
NH4+含有5个原子,8个价电子,不是SO42-的等电子体;
CCl4含有5个原子,32个价电子,和SO42-互为等电子体.
故选:B.
点评 本题考查了等电子体,解答本题关键是充分理解等电子体的本质特征,难度中等,侧重于考查学生的分析能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.几种短周期元素的原子半径及主要化合价见下表,下列叙述正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | K、M、Q三元素最高价氧化物对应的水化物两两之间可发生化学反应 | |
| B. | 元素L和N性质相似因为处于同一主族 | |
| C. | 在RCl2中,各原子最外层均满足8电子的稳定结构 | |
| D. | 氢化物沸点:H2Q>H2T |
2.微型银锌电池钮扣电池有广泛应用,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是( )
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的碱性增强 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
7.下列说法正确的是( )
| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取sp3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、C6H6都是只含有极性键的非极性分子 |
 (或
(或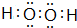
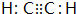 );
); 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.