题目内容
【题目】氢气是一种清洁、高效新能源,也是重要的化工原料。
(1)工业上利用甲烷制备氢气的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
已知:
①H2(g)+![]() O2(g)=H2O(g) △H1=-198kJ/mol
O2(g)=H2O(g) △H1=-198kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ/mol
则CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4=________。
CO(g)+3H2(g) △H4=________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1
CH3OH(g) △H=-116kJ/mo1
①如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_______,理由_________;Y1_____Y2 (填“<”、“=”、“>”)。
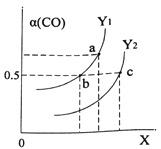
②在2L恒容密闭容器中充入2molCO和4molH2,在一定条件下经过10min达到平衡状态c 点处。则在该条件下,从开始至达到平衡状态v(CH3OH)=________,平衡常数Ka、Kb、Kc的大小关系:____________。
③下列措施既能增大反应速率又能提高反应物的转化率的是_______。
A.使用催化剂 B.及时分离CH3OH C.升高温度 D.增大压强
(3)已知燃料电池的比能量与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由小到大的顺序为___________。
【答案】 +30.7 kJ·mol-1 压强 该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大 < 0.05mol/(L·min) Ka=Kb>Kc D H2>CH4>CH3OH
【解析】(1)根据盖斯定律(③![]() 2-②-①
2-②-①![]() 6)/2: [-846.3
6)/2: [-846.3![]() 2—(-576)-(-198
2—(-576)-(-198![]() 6)]/2=+30.7 kJ·mol-1
6)]/2=+30.7 kJ·mol-1
(2) ①因为CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1,根据方程式分析,温度升高平衡向逆反应方向移动,CO的平衡转化率(α)减小,增大压强,平衡正向移动,CO的平衡转化率(α)增大,图中是随X变化CO的平衡转化率(α)增大的,所以X表示的是压强,理由该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大;由图知压强一定时,Y1的转化率大于Y2所以Y1的温度小于Y2的温度。答案:压强 ; 该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大;<。
CH3OH(g) △H=-116kJ/mo1,根据方程式分析,温度升高平衡向逆反应方向移动,CO的平衡转化率(α)减小,增大压强,平衡正向移动,CO的平衡转化率(α)增大,图中是随X变化CO的平衡转化率(α)增大的,所以X表示的是压强,理由该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大;由图知压强一定时,Y1的转化率大于Y2所以Y1的温度小于Y2的温度。答案:压强 ; 该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大;<。
②根据三段式: CO(g)+ 2H2(g)![]() CH3OH(g) c点CO的平衡转化率为0.5
CH3OH(g) c点CO的平衡转化率为0.5
起始量(mol/l) 1 2 0
变化量(mol/l) 0.5 1 0.5
平衡量(mol/l) 0.5 1 0.5
v(CH3OH)= 0.5 mol.L-/10 min= 0.05mol/(L·min)
因为平衡常数只与温度有关,a b两点同在Y1曲线上,温度相同,所以Ka= Kb。根据因为CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1为放热反应,由图知压强一定时,Y1的转化率大于Y2所以Y1的温度小于Y2的温度,升温平衡逆向移动,所以Ka=Kb>Kc。
CH3OH(g) △H=-116kJ/mo1为放热反应,由图知压强一定时,Y1的转化率大于Y2所以Y1的温度小于Y2的温度,升温平衡逆向移动,所以Ka=Kb>Kc。
③A.使用催化剂只改变化学反应速率,不能影响平衡移动,也不能改变反应物的转化率,故A不符合题意;B.及时分离CH3OH,减小生成物的浓度,平衡正向移动, 提高反应物的转化率,但化学反应速率降低,故B不符合题意;C.升高温度加快化学反应速率,但升温平衡逆向移动,降低反应物的转化率,故C不符合题意;D.增大压强加快化学反应速率,因为正反应是气体体积减小的反应,所以增大压强,平衡正向移动,反应物的转化率增大,故D符合题意。答案D。
因为燃料电池的比能量与单位质量燃料物质失去的电子数成正比,所以相同质量的H2、CH4、CH3OH的碱性电池转移的电子数为:H2![]() H2O转移的电子数m/2
H2O转移的电子数m/2![]() 2e-=m; CH4
2e-=m; CH4![]() CO2转移的电子数为m/16
CO2转移的电子数为m/16![]() 8e-=m/2;CH3OH
8e-=m/2;CH3OH![]() CO2转移的电子数为m/32
CO2转移的电子数为m/32![]() 6e-=3m/16,所以转移的电子数H2>CH4>CH3OH,其比能量由小到大的顺序为H2>CH4>CH3OH。
6e-=3m/16,所以转移的电子数H2>CH4>CH3OH,其比能量由小到大的顺序为H2>CH4>CH3OH。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案