题目内容
对于平衡体系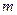 A(g)+
A(g)+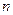 B(g)
B(g)
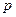 C(g)+
C(g)+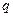 D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则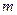 +
+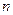 <
<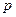 +
+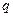
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为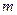 ∶
∶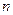
C.若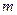 +
+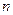 =
=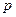 +
+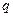 ,则往含有
,则往含有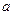 mol气体的平衡体系中再加入
mol气体的平衡体系中再加入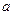 mol的B,达到新平衡时,气体的总物质的量等于2
mol的B,达到新平衡时,气体的总物质的量等于2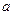
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
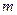 A(g)+
A(g)+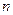 B(g)
B(g)
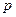 C(g)+
C(g)+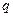 D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则
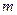 +
+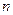 <
<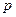 +
+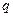
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为
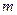 ∶
∶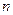
C.若
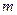 +
+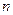 =
=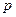 +
+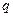 ,则往含有
,则往含有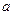 mol气体的平衡体系中再加入
mol气体的平衡体系中再加入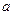 mol的B,达到新平衡时,气体的总物质的量等于2
mol的B,达到新平衡时,气体的总物质的量等于2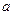
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
D
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ClF3(g);△H<0。下列叙述中,正确的是
ClF3(g);△H<0。下列叙述中,正确的是
 P(g)+Q(g) ΔH>0,
P(g)+Q(g) ΔH>0, 
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
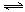 CO(g) + H2(g)
CO(g) + H2(g) 2NO2(g) △H>0,
2NO2(g) △H>0,