题目内容
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
(2)该反应达到平衡时若缩小体积,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)该条件下反应__________________(填“能”或“不能”)自发进行.
(4)在如图中画出在某时刻条件改变后的图象(其他条件不变).
t1:增大NO的浓度
t2:降低温度
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
(3)该条件下反应__________________(填“能”或“不能”)自发进行.
(4)在如图中画出在某时刻条件改变后的图象(其他条件不变).
t1:增大NO的浓度
t2:降低温度

(1)B (2)增大 减小
(3)ΔG=ΔH-T·ΔS
=-113 kJ/mol+298 K×145×10-3 kJ/(mol·K)
=-69.79 kJ/mol<0
故反应能自发进行.(2分)
(4)(2分)
(3)ΔG=ΔH-T·ΔS
=-113 kJ/mol+298 K×145×10-3 kJ/(mol·K)
=-69.79 kJ/mol<0
故反应能自发进行.(2分)
(4)(2分)

略

练习册系列答案
相关题目
 2C(g)ΔH<0。
2C(g)ΔH<0。 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:高考
2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:高考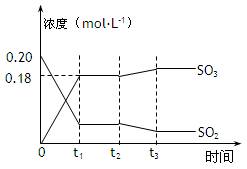
 2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。
2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。
 2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题: 时,测得混合气体的容积为120L。则a、b的值分别为:a=______________,b=______________。
时,测得混合气体的容积为120L。则a、b的值分别为:a=______________,b=______________。 体积为1 L的密闭容器中,发生如下反应:
体积为1 L的密闭容器中,发生如下反应: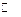 B(g) + xC(?),(正反应放热)。经t min后反应达到平衡,此时A的转化率为a,容器内压强变为原来的(1+1.5a)倍,则下列说法中正确的是( )
B(g) + xC(?),(正反应放热)。经t min后反应达到平衡,此时A的转化率为a,容器内压强变为原来的(1+1.5a)倍,则下列说法中正确的是( ) 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是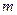 A(g)+
A(g)+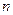 B(g)
B(g)
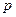 C(g)+
C(g)+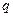 D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是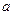 mol气体的平衡体系中再加入
mol气体的平衡体系中再加入

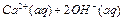 ,下列说法确的是( )
,下列说法确的是( ) 质量不变
质量不变