题目内容
【题目】过量的碳排放会引起严重的温室效应,导致海洋升温、海水酸化,全球出现大规模珊瑚礁破坏,保护珊瑚礁刻不容缓。
(1)海水中含有的离子主要有Na+、Mg2+、Ca2+、K+、Cl–、CO32–和HCO3–。其中,导致海水呈弱碱性的微粒有______。
(2)珊瑚礁是珊瑚虫在生长过程中吸收海水中物质而逐渐形成的石灰石外壳。形成珊瑚礁的主要反应为Ca2+ + 2HCO3- ![]() CaCO3↓+ CO2↑+ H2O。
CaCO3↓+ CO2↑+ H2O。
① 请结合化学用语分析该反应能够发生的原因:______。
② 与珊瑚虫共生的藻类通过光合作用促进了珊瑚礁的形成;而海洋温度升高会使共生藻类离开珊瑚礁,导致珊瑚礁被破坏。请分析珊瑚礁的形成和破坏会受到共生藻类影响的原因:______。
(3)研究人员提出了一种封存大气中二氧化碳的思路:将二氧化碳和大量的水注入地下深层的玄武岩(主要成分为CaSiO3)中,使其转化为碳酸盐晶体。玄武岩转化为碳酸盐的化学方程式为______。
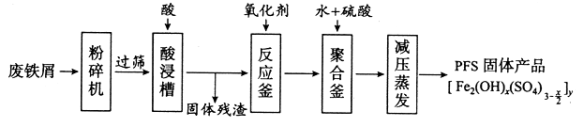
(4)“尾气CO2直接矿化磷石膏联产工艺”涉及低浓度CO2减排和工业固废磷石膏处理两大工业环保技术领域,其部分工艺流程如下图所示。
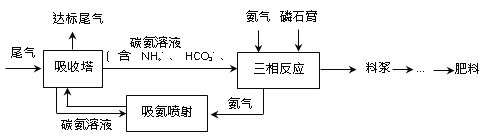
已知:磷石膏是在磷酸生产中用硫酸处理磷矿时产生的固体废渣,其主要成分为CaSO4·2H2O。
①吸收塔中发生的反应可能有______(写出任意2个反应的离子方程式)。
②料浆的主要成分是______(写化学式)。
【答案】CO32-、HCO3- HCO3-在海水中存在电离平衡:HCO3-![]() CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2 共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-
CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2 共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-![]() CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成 CaSiO3 + CO2 + H2O=CaCO3 + H2SiO3(或CaSiO3 + CO2=CaCO3 + SiO2) NH3·H2O + CO2=2NH4+ + CO32- + H2O、NH3·H2O + CO2=NH4+ + HCO3-、CO32- + CO2 + H2O=2HCO3-(写出任意2个均可) CaCO3、(NH4)2SO4
CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成 CaSiO3 + CO2 + H2O=CaCO3 + H2SiO3(或CaSiO3 + CO2=CaCO3 + SiO2) NH3·H2O + CO2=2NH4+ + CO32- + H2O、NH3·H2O + CO2=NH4+ + HCO3-、CO32- + CO2 + H2O=2HCO3-(写出任意2个均可) CaCO3、(NH4)2SO4
【解析】
(1)根据盐类水解的规律分析判断;
(2)①HCO3-在海水中存在电离平衡:HCO3-![]() CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时生成CaCO3沉淀;常见HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2,据此分析解答;②结合光合作用和Ca2+ + 2HCO3-
CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时生成CaCO3沉淀;常见HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2,据此分析解答;②结合光合作用和Ca2+ + 2HCO3-![]() CaCO3↓+ CO2↑+ H2O的平衡移动分析解答;
CaCO3↓+ CO2↑+ H2O的平衡移动分析解答;
(3)根据沉淀的转化书写反应的方程式;
(4)①二氧化碳和氨气发生反应可能生成碳酸氢铵,也可能生成碳酸铵,据此书写反应的离子方程式;②碳氨溶液中的HCO3-与氨气生成CO32-、CO32-和磷石膏(主要成分为CaSO4·2H2O)发生沉淀的转化,据此分析判断。
(1)在Na+、Mg2+、Ca2+、K+、Cl–、CO32–和HCO3–微粒中,CO32-、HCO3-水解生成氢氧根离子,导致海水呈弱碱性,故答案为:CO32-、HCO3-;
(2)①HCO3-在海水中存在电离平衡:HCO3-![]() CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2,总反应为Ca2+ + 2HCO3-
CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-进一步作用生成CO2,总反应为Ca2+ + 2HCO3- ![]() CaCO3↓+ CO2↑+ H2O,故答案为:HCO3-在海水中存在电离平衡:HCO3-
CaCO3↓+ CO2↑+ H2O,故答案为:HCO3-在海水中存在电离平衡:HCO3-![]() CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-
CO32- + H+,当c(Ca2+)与c(CO32-)的乘积大于Ksp(CaCO3)时,Ca2+与CO32-生成CaCO3沉淀;使HCO3-电离平衡正向移动,c(H+)增大,H+与HCO3-
②共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-![]() CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成,因此与珊瑚虫共生的藻类通过光合作用促进了珊瑚礁的形成;而海洋温度升高会使共生藻类离开珊瑚礁,导致珊瑚礁被破坏,故答案为:共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-
CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成,因此与珊瑚虫共生的藻类通过光合作用促进了珊瑚礁的形成;而海洋温度升高会使共生藻类离开珊瑚礁,导致珊瑚礁被破坏,故答案为:共生藻类存在,会通过光合作用吸收CO2,使平衡:Ca2+ + 2HCO3-![]() CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成;
CaCO3↓+ CO2↑+ H2O正向移动,促进珊瑚礁的形成;共生藻类死亡,使海水中CO2的浓度增大,使上述平衡逆向移动,抑制珊瑚礁的形成;
(3)将二氧化碳和大量的水注入地下深层的玄武岩(主要成分为CaSiO3)中,使其转化为碳酸盐晶体,反应的化学方程式为CaSiO3 + CO2 + H2O = CaCO3 + H2SiO3,故答案为:CaSiO3 + CO2 + H2O = CaCO3 + H2SiO3;
(4)①根据流程图,吸收塔中吸收了尾气中的二氧化碳和进入吸收塔的氨气发生反应生成了碳氨溶液,反应的方程式可能有NH3·H2O + CO2 = 2NH4+ + CO32- + H2O、NH3·H2O + CO2 =NH4+ + HCO3-、CO32- + CO2 + H2O =2HCO3-,故答案为:NH3·H2O + CO2 = 2NH4+ + CO32- + H2O、NH3·H2O + CO2 =NH4+ + HCO3-、CO32- + CO2 + H2O =2HCO3-;
②碳氨溶液(含NH4+、HCO3-)、氨气、和磷石膏(主要成分为CaSO4·2H2O)发生三相反应,HCO3-与氨气反应生成CO32-和NH4+,CO32-与CaSO4·2H2O反应生成碳酸钙沉淀和硫酸根离子,因此料浆的主要成分有CaCO3、(NH4)2SO4,故答案为:CaCO3、(NH4)2SO4。