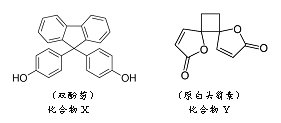
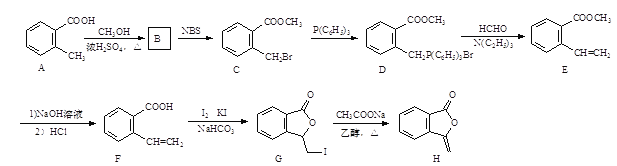
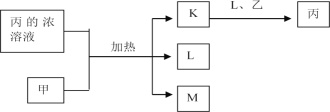
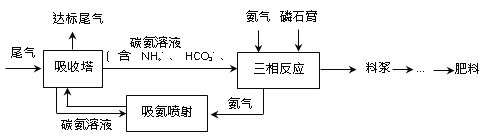
题目内容
【题目】从海水提取镁和溴的流程如图,请回答相关问题。
(1)从海水中提取镁的流程如图所示(框图中是主要产物):
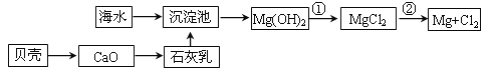
i.反应①的离子方程是_____;
ii.反应②的化学方程式是_____。
(2)从海水中提取溴的流程如图所示(框图中是主要产物):
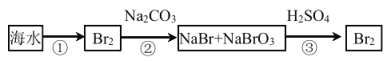
i.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______。
ii.过程③中反应的化学方程式是______。
iii.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是______。(结合离子方程式回答)。
【答案】Mg(OH)2+2H+=Mg2++2H2O MgCl2(熔融) ![]() Mg+Cl2↑ 温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸气的逸出 5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O 加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-═Br2+2Cl-
Mg+Cl2↑ 温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸气的逸出 5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O 加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-═Br2+2Cl-
【解析】
(1)根据流程图中物质间的转化关系书写方程式;
(2) i.根据气体在水中的溶解度的影响因素结合溴易挥发分析热空气吹入法的原理和目的;ii.根据流程图中物质间的转化关系书写方程式;iii.根据氯气能将溴离子氧化为溴单质,结合除杂原则分析解答。
(1)i.反应①是Mg(OH)2与盐酸反应转化为MgCl2,反应的化学方程式为:2HCl+Mg(OH)2═MgCl2+2H2O,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O;
ii.反应②为电解熔融的氯化镁生成镁和氯气,反应的化学方程式为MgCl2(熔融) ![]() Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)i.溴是易挥发的液体单质,向混合液中吹入热空气,温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸气的逸出,故答案为:温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸气的逸出;
ii.过程③中酸性条件下NaBr、NaBrO3发生氧化还原反应生成溴单质,反应的化学方程式为3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O,故答案为:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O;
iii.氯气具有氧化性,溴离子具有还原性,若最终得到的溴单质中仍然混有少量的Cl2,可以加入适量溴化钠,再利用有机溶剂将溴分离提纯,Cl2+2Br-═Br2+2Cl-,则可除去杂质氯气,故答案为:加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-═Br2+2Cl-。

【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。下列说法正确的是( )
X | Y | |
Z | W |
A.原子半径:X>Y>Z>W
B.若它们都能形成气态氢化物,则Z的氢化物稳定性最强
C.若常温下它们的单质中只有Z为固态,则W单质的水溶液具有漂白性
D.若X与W形成的化合物的电子式是![]() ,则Y属于第ⅣA族
,则Y属于第ⅣA族