题目内容
20.0.4molCO2和0.8molCO 中含有碳原子的物质的量之比为1:2,含有氧元素的质量之比为1:1,两物质在同温同压下的体积之比为1:2,含有电子的物质的量之比为11:14.分析 每个CO2、CO 分子均含有1个碳原子,含有碳原子物质的量分别等于二氧化碳、CO的物质的量;
二氧化碳分子含有2个氧原子,氧原子物质的量为二氧化碳的2倍,而CO分子含有1个氧原子,则氧原子物质的量等于CO物质的量,根据m=nM计算含有氧元素质量之比;
由V=nVm可知,同温同压下,气体的体积之比等于其物质的量之比;
每个CO2分子含有22个电子,电子物质的量为二氧化碳的22倍,每个CO 分子含有14个电子,含有电子物质的量为CO的14倍.
解答 解:每个CO2、CO 分子均含有1个碳原子,0.4molCO2和0.8molCO 中含有碳原子的物质的量之比为0.4mol:0.8mol=1:2;
二氧化碳分子含有2个氧原子,氧原子物质的量为二氧化碳的2倍,而CO分子含有1个氧原子,则氧原子物质的量等于CO物质的量,0.4molCO2和0.8molCO 中含有含有氧元素质量之比=0.4mol×2:0.8mol=1:1;
由V=nVm可知,同温同压下,气体的体积之比等于其物质的量之比,则0.4molCO2和0.8molCO的体积之比为0.4mol:0.8mol=1:2;
每个CO2分子含有22个电子,电子物质的量为二氧化碳的22倍,每个CO 分子含有14个电子,含有电子物质的量为CO的14倍,0.4molCO2和0.8molCO 中含有电子的物质的量之比为0.4mol×22:0.8mol×14=11:14,
故答案为:1:2;1:1;1:2;11:14.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
17.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 100mL 0.1mol/L K2SO4溶液中,含有氧原子数为0.04NA | |
| B. | 标准状况下,2.24L氯气溶于水发生反应,转移电子数目为0.1NA | |
| C. | 1mol Na与足量O2反应生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中,含有0.2NAOH- |
11.赫克反应、根岸反应和铃木反应已成为化学家们制造复杂化学分子的“精致工具”,在科研、医药和电子等领域经广泛应用.下面是由铃木反应合成出来的一种联苯的衍生物,(用字母“K”表示),下列叙述正确的是( )


| A. | “K”属于芳香烃 | |
| B. | “K”的苯环上的一硝基取代产物有5种 | |
| C. | “K”中含有三种官能团 | |
| D. | 11mol“K”最多可和6molH2发生加成反应 |
8.如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
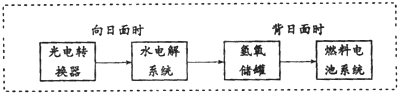

| A. | 该能量转化系统中的水也是可以循环的 | |
| B. | 燃料电池放电时的负极反应:H2-2e-+2OH-═2H2O | |
| C. | 水电解系统中的阳极反应:4OH--4e-═2H2O+O2↑ | |
| D. | 燃料电池系统产生的能量实际上来自于水 |
15.等物质的量的下列烃完全燃烧,消耗的氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
9.如图是A、B两种重要的有机合成原料.下列有关说法中正确的是( )


| A. | A与B互为同系物 | |
| B. | A与B都能与溴的四氯化碳溶液发生加成反应 | |
| C. | 在一定条件下,A与B均能发生取代反应 | |
| D. | A与B都能与碳酸氢钠反应产生氢气 |
10.现有甲、乙、丙、丁和Fe(OH)3五种胶体,把甲与丙、乙与丁、丙与丁、丙与Fe(OH)3胶体两两混合,均出现胶体凝聚,则胶体粒子带负电荷的胶体是( )
| A. | 甲和乙 | B. | 乙和丙 | C. | 丙和丁 | D. | 丁和甲 |
 回答下列问题.
回答下列问题.