题目内容
20.把钠放入滴有酚酞试液的水中,下列现象不会出现的是( )| A. | 钠浮在水面上 | B. | 钠熔化成小球 | ||
| C. | 溶液中产生较多的气泡 | D. | 水溶液变成红色 |
分析 钠的密度小于水,熔点较低,能和水剧烈反应生成氢氧化钠和氢气,且放出大量热,氢氧化钠能电离出氢氧根离子而使其溶液呈碱性,据此分析解答.
解答 解:A.钠的密度小于水,所以钠会浮在水面上,故A不选;
B.钠的熔点较低,钠和水剧烈反应生成氢氧化钠和氢气,同时放出大量的热,放出的热量使钠熔成小球,故B不选;
C.钠和水剧烈反应生成氢气,反应速度很快,且浮在水面上,不会从溶液中冒出气泡,故C选;
D.钠和水反应生成氢氧化钠,氢氧化钠电离出氢氧根离子而使其溶液呈碱性,无色酚酞遇碱变红色,故D不选;
故选C.
点评 本题考查了钠与水的反应,明确钠及氢氧化钠的性质是解本题关键,会根据实验现象得出正确结论,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.己知一个反应只能在高温下进行,则它的逆反应( )
| A. | 只能在高温下进行 | |
| B. | 只能在低温下进行 | |
| C. | 可能在高温下进行,也可能能在高温下进行 | |
| D. | 在高温或低温下均不能进行 |
11.对于平衡体系mA(气)+nB(气)?PC(气)十qD(气)△H<0,有下列判断,其中正确的是( )
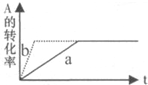

| A. | 若温度不变,将容器的体积缩小1倍,此时A的浓度变为原来的1.8倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时A,B的物质的量之比为m:n | |
| C. | 若平衡体系共有气体amol,再向其中加人bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q | |
| D. | 加催化剂或增大压强,可实现如图a→b的变化 |
8.下列溶液中,c(Cl-)最小的是( )
| A. | 20 mL 0.5 mol/L AlCl3溶液 | B. | 30 mL 1 mol/L KCl溶液 | ||
| C. | 7.5 mL 2 mol/L MgCl2溶液 | D. | 10 mL 3 mol/L NaCl溶液 |
15.下列反应中,属于氧化还原反应的是( )
| A. | CaCO3+2HCl═CaCl2+CO2↑+H2O | B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | ||
| C. | Fe2O3+6HCl═2FeCl3+3H2O | D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O |
5.浊液区别于其他分散系最本质的特征是( )
| A. | 外观浑浊不清 | B. | 浊液没有丁达尔现象 | ||
| C. | 不稳定 | D. | 分散质粒子直径大于1ⅹ10-7m |