题目内容
A、B、C、D四种物质都含有同种元素且有如图所示转化关系。试回答下列问题: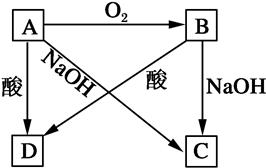
(1)若A是一种常见非金属,且是一种半导体材料。写出下列反应的方程式。
①B→D的化学方程式:__________________________________________________;
②A→C的离子方程式:__________________________________________________。
(2)若A是一种常见金属,此时酸为强酸。写出:A→D的离子方程式:__________________________。
(1)①SiO2+4HF=2H2O+SiH4↑ ②Si+2OH-+H2O=SiO32-+2H2↑
(2)2Al+6H+=2Al3++3H2↑
解析试题分析:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等,据此可以判断。
(1)若A是一种常见非金属,且是一种半导体材料,则A是单质硅。硅单质与氧气反应生成二氧化硅,即B是SiO2;二氧化硅是酸性氧化物能和氢氧化钠溶液反应生成硅酸钠和水,则C是硅酸钠;单质硅也能和氢氧化钠溶液反应生成硅酸钠和氢气。硅是非金属单质,只能和氢氟酸反应生成四氟化硅和氢气。二氧化硅也能和氢氟酸反应生成四氟化硅和水,则D是SiH4。因此
①B→D的化学方程式为SiO2+4HF=2H2O+SiH4↑;
A→C的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。
(2)若A是一种常见金属,金属中能和氢氧化钠溶液反应的是金属铝,即A是Al。铝在氧气中燃烧生成氧化铝,即B是氧化铝。铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,则C是偏铝酸钠。氧化铝是两性氧化物,也能和氢氧化钠溶液反应生成偏铝酸钠。如果此时酸为强酸,则D是铝盐,所以A→D的离子方程式为2Al+6H+=2Al3++3H2↑。
考点:考查无机物推断的有关判断

下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是【用化学式表示】 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为 ,N→⑥的单质的化学方程式为 。

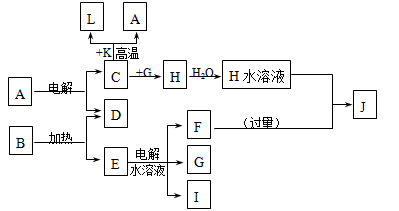

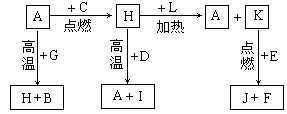

 (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);