题目内容
8.在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)?H2(g)+CO(g)△H>0 达到平衡后,改变下列反应条件,相关叙述正确的是( )| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入少量C,正反应速率增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入CO,混合气体的密度增大 |
分析 A.加入H2O(g)即增加反应物的浓度,平衡向正反应方向移动,正反应又是气体体积增大的方向;
B.C为固体,增大碳的用量不影响反应速率;
C.降低温度,平衡向放热反应方向移动;
D.加入CO即增加生成物的浓度,虽然平衡向逆反应方向移动,但因为增加了CO,所以气体总质量仍然在变大;
解答 解:A.加入H2O(g)即增加反应物的浓度,平衡向正反应方向移动,正反应又是气体体积增大的方向,所以体系压强增大,故A错误;
B.C为固体,增大碳的用量不影响反应速率,故B错误;
C.降低温度,平衡向放热反应方向移动,即逆反应方向移动,故C错误;
D.加入CO即增加生成物的浓度,虽然平衡向逆反应方向移动,但因为增加了CO,所以气体总质量仍然在变大,体积不变,所以密度增大,故D正确;
故选D.
点评 本题考查化学平衡的影响因素,题目难度不大,本题注意观察方程式的特征,把握外界条件对平衡状态的影响.

练习册系列答案
相关题目
18.设阿伏伽德罗常数为NA,下列说法正确的是( )
| A. | pH=1 的H2SO4溶液中所含H+的个数为0.1NA | |
| B. | 100mL 0.1mol•L-1的NH4Cl溶液所含NH4+的个数为0.01NA | |
| C. | 电解精炼铜的过程中,外电路转移NA个电子,阴极生成铜的质量为32g | |
| D. | 将2molSO2和10molO2充入一密闭容器中完全反应后,生成SO3的分子数为2NA |
19.碳具有还原性,能与氧化铜发生反应:2CuO+C $\frac{\underline{\;高温\;}}{\;}$ 2Cu+CO2↑,该反应的基本类型为( )
| A. | 置换反应 | B. | 化合反应 | C. | 分解反应 | D. | 复分解反应 |
16.下列作用不属于水解反应的是( )
| A. | 吃馒头时多咀嚼后有甜味 | |
| B. | 淀粉溶液和稀H2SO4共热一段时间后,滴加碘水不显蓝色 | |
| C. | 把生鸡蛋煮成熟鸡蛋 | |
| D. | 油脂与NaOH溶液共煮后可以制得肥皂 |
3.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,下列推断正确的是( )
| A. | 负极反应为7O2+14 H2O+28e-→28OH- | |
| B. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 放电过程中KOH的物质的量浓度减小 |
13.下列说法中不正确的是( )
| A. | 元素电负性越大的原子,吸引电子的能力越强 | |
| B. | 在NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 在晶体钋(简单立方堆积)中,每个钋原子周围紧密相邻的钋原子有8个 | |
| D. | CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为配位键 |
20.下列关于原电池说法正确的是( )
| A. | 原电池是一种直接把化学能转化为电能的装置,在此转化过程中无能量损耗 | |
| B. | 在Zn-Cu-H2SO4构成的原电池中,H+不断移向负极 | |
| C. | 钢铁在潮湿的环境中易被腐蚀与原电池有关 | |
| D. | 纯铁比生铁(含有少量杂质)与稀HCl反应快 |
17.下列物质中,不能用直接化合制取的是( )
| A. | Fe(OH)3 | B. | FeCl3 | C. | CuS | D. | FeCl2 |
18.某有机化合物的结构简式如图所示,下列叙述不正确的是( )
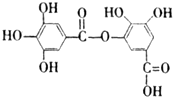

| A. | 它有酸性,能与纯碱溶液反应 | |
| B. | 它在一定条件下能发生水解,且产物只有一种 | |
| C. | 1 mol该有机物最多能与7 mol NaOH反应 | |
| D. | 1 mol该有机物最多能与4 mol Br2反应 |