题目内容
6.某温度时反应C(S)+2H2?CH4的K=8.28,当各气体物质的量浓度分别为H20.7mol/l、CH40.2mol/l 时,上述反应( )| A. | 正向移动 | B. | 逆向移动 | C. | 达到平衡 | D. | 不一定 |
分析 计算此时刻的浓度商Qc,与平衡常数比较,若Qc=k,处于平衡状态,若Qc>k,反应向逆反应进行,若Qc<k,反应向正反应进行,据此解答.
解答 解:对于反应C(s)+2H2(g)?CH4(g),当H2 0.7mol•L-1、CH4 0.2mol•L-1时,此时的浓度商Qc=$\frac{0.2}{0.{7}^{2}}$=0.41<8.28,反应向正反应进行,故选A.
点评 考查化学平衡常数的有关计算与意义,难度不大,注意化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率.

练习册系列答案
相关题目
16.下列有关乙醇、乙酸的说法,错误的是( )
| A. | 乙醇和乙酸都可以发生酯化反应 | |
| B. | 乙醇和乙酸都可以与钠反应生成氢气 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸都含有羟基,二者是同分异构体 |
17.向1L下列溶液中加入0.5mol NaOH固体,溶液的导电能力基本没有变化的是( )
| A. | 0.5 mol•L-1盐酸 | B. | 0.5 mol•L-1 KOH溶液 | ||
| C. | 0.5 mol•L-1醋酸 | D. | 0.5 mol•L-1Na2SO4 |
14.设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1L 1mol•L-1的CH3COOH溶液中含有NA个氢离子 | |
| B. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 1g O2和1g O3中所含有的电子数均为0.5NA |
3.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见表:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取.
①分离出甲醇的操作是的蒸馏.
②萃取用到的分液漏斗使用前需检验漏并洗净,分液时有机层在分液漏斗的上填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是①除去HCl;用饱和食盐水洗涤的目的是②除去少量NaHCO3且减少产物损失.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是dcab(填字母).
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)反应可能出现的副产物的结构简式为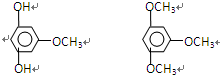 .
.

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 | / | 33~36 | / | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是的蒸馏.
②萃取用到的分液漏斗使用前需检验漏并洗净,分液时有机层在分液漏斗的上填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是①除去HCl;用饱和食盐水洗涤的目的是②除去少量NaHCO3且减少产物损失.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是dcab(填字母).
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)反应可能出现的副产物的结构简式为
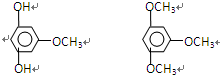 .
.
4.对于容积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g);△H<0,在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述不正确的是( )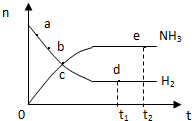

| A. | 点a处的正反应速率比点b处的大 | |
| B. | 点c处的正反应速率与逆反应速率相等 | |
| C. | 点d(t1时刻)的n(N2)比点e(t2时刻)处的n(N2)大 | |
| D. | 其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变小 |