题目内容
14.七种短周期元素在元素周期表中的相对位置如表所示.其中B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,下列说法正确的是( )| A | B | C | ||
| D | E | F | G |
| A. | 氧化物对应的水化物的酸性:G一定强于F | |
| B. | 简单离子的半径:F>G>C>D | |
| C. | 1mol EC2中含2mol E-C键 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
分析 短周期元素中,B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,则B为N元素;由元素的相对位置可知,A为碳元素,C为O元素,D为Al,E为Si,F为S,G为Cl.
A.应是最高价氧化物对应的水化物的酸性:G一定强于F;
B.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
C.1mol SiO2属于原子晶体,晶体中Si原子与周围的4个O原子形成4个Si-O键;
D.A与氢元素形成的化合物为烃,烃分子中碳原子之间为非极性键.
解答 解:短周期元素中,B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,则B为N元素;由元素的相对位置可知,A为碳元素,C为O元素,D为Al,E为Si,F为S,G为Cl.
A.应是最高价氧化物对应的水化物的酸性:G一定强于F,不是最高价含氧酸,则不一定,如HClO为弱酸,而硫酸为强酸,故A错误;
B.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径S2->Cl->O2->Al3+,故B正确;
C.1mol SiO2属于原子晶体,晶体中Si原子与周围的4个O原子形成4个Si-O键,1mol SiO2含4mol Si-O键,故C错误;
D.G与氢元素形成的化合物为HCl,原子之间为极性键,但A与氢元素形成的化合物为烃,烃分子中碳原子之间为非极性键,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,注意对元素周期表的掌握,D选项中注意碳元素与氢元素形成烃,学生容易只考虑甲烷.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列属于纯净物的是( )
| A. | 水玻璃 | B. | 漂白粉 | ||
| C. | 纯净的盐酸 | D. | 氧元素质量分数为50%的SO2 |
9.丹参素的结构简式为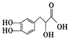 ,下列有关丹参素的说法错误的是( )
,下列有关丹参素的说法错误的是( )
 ,下列有关丹参素的说法错误的是( )
,下列有关丹参素的说法错误的是( )| A. | 能燃烧且完全燃烧生成CO2和H2O | B. | 不能发生加成反应 | ||
| C. | 可以发生酯化反应 | D. | 能与NaHCO3、Na反应 |
19.将铁屑溶于过量的盐酸后,再加入下列物质,有Fe3+生成的是( )
①稀H2SO4 ②氯水 ③Zn(NO3)2 ④CuCl2.
①稀H2SO4 ②氯水 ③Zn(NO3)2 ④CuCl2.
| A. | 只有② | B. | ②③ | C. | ③④ | D. | ②④ |
4.适量CO2通入含0.8gNaOH的碱溶液中,将所得的溶液在减压、低温下蒸干 后得到1.0g固体物质,则该固体物质的成分是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3、NaHCO3 | D. | Na2CO3、NaOH |