题目内容
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
【答案】B
【解析】
A. 根据电解总反应可知,铜电极化合价升高,失电子,发生氧化反应,故A错误;
B. 根据电解总反应可知,铜电极化合价升高,失电子Cu2O,石墨电极氢离子得电子产生氢气,故B正确;
C. 铜电极铜电极化合价升高,失电子,应该接直流电源的正极,故C错误;
D. 2Cu~Cu2O,当有0.1 mol电子转移时,有0.05 mol Cu2O生成,故D错误;
正确答案:B。

练习册系列答案
相关题目
【题目】X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是
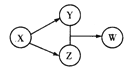
A | B | C | D | |
X | HCl | Na202 | Na2C03 | Al |
Y | FeCl2 | NaOH | CO2 | Na[Al(OH)4] |
Z | Cl2 | Na2C03 | CaC03 | AlCl3 |
W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
A. A B. B C. C D. D