题目内容
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{HO(CH2)5COOH}及阻燃剂四溴双酚A。合成线路如下图所示:
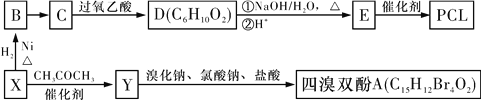
已知:①X的蒸气密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为O。
②ROH![]() RBrOHBr。
RBrOHBr。
③RCOCH2R′![]() RCOOCH2R′。
RCOOCH2R′。
(1)X的分子式为____________;B的名称是__________。
(2)B→C还需要的反应试剂及条件是________________________。C→D的反应类型是______________。
(3)写出X→Y的化学方程式: _______________________________________。
(4)0.5 mol四溴双酚A在常温下与足量的Na2CO3溶液反应,最多消耗________mol Na2CO3。
(5)符合以下条件的C的同分异构体有__________种(不考虑立体异构)。
①含有两个甲基 ②含有一个碳碳双键 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:2CH3CHCH2+2ROH+2CO+O2![]() 2CH3CHCHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料CHCH2COOCH2CH3,写出合成该涂料的反应流程图。_________________
2CH3CHCHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料CHCH2COOCH2CH3,写出合成该涂料的反应流程图。_________________
【答案】 C6H6O 环己醇 O2、Cu/Ag、加热 氧化反应 2OH+CH3CCH3O![]() HOCCH3CH3OH+H2O 1 1 CH2===CH2
HOCCH3CH3OH+H2O 1 1 CH2===CH2![]() CH3CH2OH
CH3CH2OH![]() CH2===CHCOOCH2CH3
CH2===CHCOOCH2CH3![]() CH2CHCOOCH2CH3
CH2CHCOOCH2CH3
【解析】X的蒸汽密度是相同条件下H2的47倍,其相对分子质量为47×2=94,遇FeCl3溶液显紫色,说明含有酚羟基,则X为![]() ,X和氢气发生加成反应生成B为
,X和氢气发生加成反应生成B为![]() ,C为
,C为![]() ,则B发生催化氧化反应,PCL为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应然后酸化得到E,结合信息可知D的结构简式为
,则B发生催化氧化反应,PCL为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应然后酸化得到E,结合信息可知D的结构简式为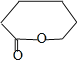 。根据题给信息②知,Y结构简式为
。根据题给信息②知,Y结构简式为![]() ,四溴双酚A结构简式为
,四溴双酚A结构简式为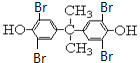 。(1)X为苯酚,其分子数为C6H6O,B为环己醇;(2)B→C还需要的反应试剂及条件是O2、Cu、加热,C生成D的反应是氧化反应;(3)X→Y的化学方程式:
。(1)X为苯酚,其分子数为C6H6O,B为环己醇;(2)B→C还需要的反应试剂及条件是O2、Cu、加热,C生成D的反应是氧化反应;(3)X→Y的化学方程式:![]() ;(4)四溴双酚A能和NaOH溶液发生取代反应后生成的酚羟基、HBr能和NaOH发生中和反应,0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗5molNaOH;(5)D结构简式为
;(4)四溴双酚A能和NaOH溶液发生取代反应后生成的酚羟基、HBr能和NaOH发生中和反应,0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗5molNaOH;(5)D结构简式为 ,D的同分异构体符合下列条件:①含有两个甲基和两种官能团,为醛基和羟基或碳碳双键和羟基;②能使溴的CCl4溶液褪色,说明含碳碳双键; ③能发生银镜反应说明含有醛基,符合条件的同分异构体有:HCOOCH2CH=C(CH3)2、HCOOC(CH3)CH=CH2、HCOOCH(CH3)CH=CHCH3、HCOOCH(CH3)C(CH3)=CH2、HCOOCH2C(CH3)=CH2CH3、HCOOC(CH2CH3)=CHCH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH3)=CHCH2CH3、HCOOCH=C(CH3)CH3、HCOOCH=CHCH(CH3)2,共10种;(6)一定条件下乙烯和水发生加成反应生成CH3CH2OH,CH3CH2OH和CH2=CH2、CO、O2反应生成CH2=CHCOOCH2CH3,CH2=CHCOOCH2CH3发生加聚反应生成高分子化合物,其流程图为
,D的同分异构体符合下列条件:①含有两个甲基和两种官能团,为醛基和羟基或碳碳双键和羟基;②能使溴的CCl4溶液褪色,说明含碳碳双键; ③能发生银镜反应说明含有醛基,符合条件的同分异构体有:HCOOCH2CH=C(CH3)2、HCOOC(CH3)CH=CH2、HCOOCH(CH3)CH=CHCH3、HCOOCH(CH3)C(CH3)=CH2、HCOOCH2C(CH3)=CH2CH3、HCOOC(CH2CH3)=CHCH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH3)=CHCH2CH3、HCOOCH=C(CH3)CH3、HCOOCH=CHCH(CH3)2,共10种;(6)一定条件下乙烯和水发生加成反应生成CH3CH2OH,CH3CH2OH和CH2=CH2、CO、O2反应生成CH2=CHCOOCH2CH3,CH2=CHCOOCH2CH3发生加聚反应生成高分子化合物,其流程图为![]() 。
。

【题目】草酸晶体的组成可表示为H2C2O4·xH2O,某研究性学习小组用下图装置进行“草酸晶体受热分解的部分产物的验证”的实验。请回答下列问题。

【资料查阅】
①草酸晶体在101 ℃时开始熔化,150 ℃时开始升华,175 ℃时开始分解;
②草酸钙和草酸氢钙均为白色不溶物。
(1)按照如图所示的装置,通过实验检验草酸晶体的部分分解产物,装置B中可观察到有气泡冒出且澄清石灰水变浑浊,由此甲同学判断草酸晶体分解的产物中有CO2。但立即遭到乙同学反对,其反对的理由可能是______________________________________。
(2)丙同学认为草酸晶体分解的产物中含有CO,为进行验证,X应选用________(填化学式)浓溶液,装置D的作用是____________________。
(3)实验过程中涉及如下操作:①点燃装置A处的酒精灯;②熄灭装置A处的酒精灯;③点燃装置E处的酒精灯;④熄灭装置E处的酒精灯。这4步操作由先到后的顺序为____________(填序号)。点燃E处酒精灯前必须要进行的操作是______________。
(4)实验过程中发现装置E中黑色粉末变红色,装置F中有黑色固体生成,经检测装置F中的固体为金属单质,则装置F中发生反应的化学方程式为________________________________________________________________________。
(5)丁同学用滴定法测定草酸晶体中结晶水的含量,进行了下列操作:
步骤一:用分析天平称取3.15 g纯净的该草酸晶体,配制成250 mL溶液。
步骤二:用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化。
步骤三:取0.100 mol·L-1标准酸性KMnO4溶液,进行滴定,三次结果如下表所示:
第一次 | 第二次 | 第三次 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知滴定反应的离子方程式为:MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入________,洗涤,定容,摇匀。
②通过计算确定x=________。


